ASPECTO MACRO Y MICROSCOPICO EN TEJIDOS DEL PERIODONTO
Introducción En este capítulo se hace una breve descripción de las características del periodonto normal. Se supone que el lector posee conocimientos previos de embriología e histología bucal. El periodonto (peri = alrededor, odontos = diente) comprende los siguientes tejidos (Fig. 1-1): 1) la encía (E), 2) el ligamento periodontal (LP), el cemento radicular (CR) y 4) el hueso alveolar (HA). El hueso alveolar consta de dos componentes, el hueso alveolar propiamente dicho (HAPD) y la apófisis alveolar (proceso alveolar). El hueso alveolar propiamente dicho, también denominado “hueso alveolar fasciculado”, se continúa con la apófisis alveolar y forma la delgada placa ósea que reviste el alvéolo dental. La función principal del periodonto consiste en unir el diente al tejido óseo de los maxilares y en mantener la integridad en la superficie de la mucosa masticatoria de la cavidad bucal. El periodonto, también llamado “aparato de inserción” o “tejidos de sostén de los dientes”, constituye una unidad de desarrollo, biológica y funcional, que experimenta determinados cambios con la edad y que además está sometida a modificaciones morfológicas relacionadas con alteraciones funcionales y del medioambiente bucal. El desarrollo de los tejidos periodontales se produce durante la formación y el desarrollo de los dientes. Este proceso comienza temprano en la fase embrionaria, cuando células de la cresta neural (del tubo neural del embrión) migran al interior del primer arco branquial. En esta posición, las células de la cresta neural forman una banda de ectomesénquima por debajo del epitelio del estomodeo (la cavidad oral primitiva). Después de que células de la cresta neural no diferenciadas arriban a su ubicación en los maxilares, el epitelio del estomodeo libera factores que inician interacciones epitelio-ectomesenquimáticas. Una vez producidas estas interacciones, el ectomesénquima adopta el papel dominante en el

desarrollo futuro. Después de la formación de la lámina dental se inicia una serie de procesos (estadio de brote o germen dentario, estadio de casquete, estadio de campana con desarrollo radicular) que dan por resultado la formación de un diente y de los tejidos periodontales que lo circundan, incluido el hueso alveolar propiamente dicho. Durante el estadio de casquete se produce una condensación de células ectomesenquimáticas en relación con el epitelio dental (el órgano dental [DO]), y se forma la papila dental (DP) que da origen a la dentina y la pulpa,
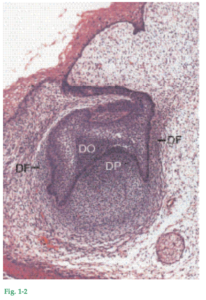
y el folículo dental (DF) que origina los tejidos de sostén periodontales (Fig. 1-2). El papel decisivo que desempeña el ectomesénquima en este proceso queda establecido adicionalmente por el hecho de que la papila dental también determina aparentemente la forma y configuración del diente. Si un diente en formación en estadio de campana es resecado y trasplantado a un sitio ectópico (p. ej., el tejido conjuntivo de la cámara anterior del ojo), el proceso de formación dentaria continúa. Se forman la corona y la raíz y también se desarrollan las estructuras de sostén, es decir, cemento, ligamento periodontal y una lámina delgada de hueso alveolar propiamente dicho. Estos experimentos documentan que toda la información necesaria para la formación de un diente y de su aparato de inserción reside dentro de los tejidos del órgano dental y del ectomesénquima que lo rodea. El órgano dental es el formador del esmalte, la papila dental es el órgano formador del complejo pulpodentinario y el folículo dental es el órgano formador del aparato de inserción (cemento, ligamento periodontal y hueso alveolar propiamente dicho). El desarrollo de la raíz y de los tejidos periodontales de sostén es ulterior al de la corona. Las células de los epitelios externo e interno (del órgano dental) proliferan en dirección apical, y forman una doble capa de células denominada vaina radicular epitelial de Hertwig (RS). Los odontoblastos (OB) que forman la dentina de la raíz se diferencian de las células ectomesenquimáticas de la papila dental por el efecto inductor de las células del epitelio interno (Fig. 1-3).

La dentina (D) continúa formándose en dirección apical, dando origen a la estructura de la raíz. Durante la formación de la raíz se desarrollan los tejidos periodontales de sostén, incluido el cemento acelular. Si bien algunos de los fenómenos de la cementogénesis aún no están claros, está surgiendo gradualmente el concepto que se expone a continuación. Al iniciarse la formación de la dentina, las células interiores de la vaina radicular epitelial de Hertwig sintetizan y segregan proteínas relacionadas con el esmalte, probablemente pertenecientes a la familia de la amelogenina. Al final de este período, se desarrollan fenestraciones en la vaina de Hertwig y a través de ellas ingresan células ectomesenquimáticas del folículo dental, que contactan con la superficie radicular. Las células ectomesenquimáticas en contacto con las proteínas relacionadas con el esmalte se
diferencian en cementoblastos y empiezan a formar cementoide. Este cementoide representa la matriz orgánica del cemento y se compone de una sustancia rica en glucosaminoglucanos (sustancia fundamental) y fibras colágenas, las que se entremezclan con fibras colágenas de la capa externa de la dentina, todavía no mineralizada por completo. Se supone que el cemento se une fuertemente a la dentina por medio de esta interacción de las fibras. La formación del cemento celular, que recubre el tercio apical de las raíces dentales, difiere de la del cemento acelular dentro del cual algunos cementoblastos quedan incluidos. Las partes restantes del periodonto provienen de las células ectomesenquimáticas del folículo dental que rodean al cemento. Algunas de estas células se diferencian y dan fibroblastos periodontales, formadores de las fibras del ligamento periodontal, mientras que otras se transforman en osteoblastos productores del hueso alveolar propiamente dicho, en el que quedan ancladas las fibras periodontales. En otras palabras, la pared primaria del alvéolo es también producto del ectomesénquima. Es probable, pero aún no se ha comprobado, que en el periodonto maduro permanezcan células ectomesenquimáticas capaces de participar en el recambio de ese tejido.
Encía
Anatomía macroscópica La mucosa bucal (membrana mucosa) se continúa con la piel de los labios y con las mucosas del paladar blando y de la faringe. La mucosa bucal consta de: 1) la mucosa masticatoria que incluye la encía y la cubierta del paladar duro, 2) la mucosa especializada que recubre la cara dorsal de la lengua y 3) la parte restante denominada mucosa de revestimiento. Fig. 1-4 La encía es la parte de la mucosa masticatoria que recubre la apófisis alveolar y rodea la porción cervical de los dientes. Está compuesta de una capa epitelial y un tejido conjuntivo subyacente denominado lámina propia. La encía adquiere su forma y textura definitivas con la erupción de los dientes. En sentido coronario, la encía de color rosado coralino termina en el margen gingival libre, que tiene contornos festoneados. En sentido apical, la encía se continúa con la mucosa alveolar (mucosa de revestimineto) laxa y de color rojo oscuro, de la cual está separada por una línea demarcatoria por lo general fácilmente reconocible llamada unión mucogingival (flechas) o línea mucogingival.
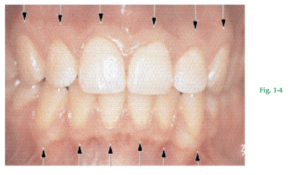
Fig. 1-5 No existe una línea mucogingival en el lado palatino, pues el paladar duro y la apófisis alveolar del maxilar superior están revestidos por el mismo tipo de mucosa masticatoria. Fig. 1-6 Se puede distinguir dos partes de la encía: 1. La encía libre (EL) 2. La encía adherida (EA) La encía libre es de color rosado coralino, con superficie opaca y consistencia firme. Comprende el tejido gingival en las caras vestibular y lingual/palatina de los dientes y la encía interdental o papilas interdentales. En las caras vestibular y lingual de los dientes, la encía libre se extiende desde el borde gingival en sentido apical, hasta la línea de la encía libre, ubicada a un nivel que corresponde a la unión cementoadamantina (UCA o unión cementoadamantina). La encía adherida está delimitada en sentido apical por la unión mucogingival (UMG). Fig. 1-7 El margen gingival libre es a menudo redondeado, de modo que se forma una pequeña invaginación o surco entre el diente y la encía (Fig. 1-7a).
Cuando se inserta más apicalmente una sonda periodontal en esta invaginación, hacia la unión cementoadamantina, el tejido gingival es separado del diente y se abre artificialmente una “bolsa gingival” (“grieta gingival” o “bolsa periodontal”). Por lo tanto, en la encía normal o clínicamente sana no existe “bolsa gingival”, sino que la encía se halla en estrecho contacto con la superficie del esmalte. En la ilustración de la derecha (Fig. 1-7b) se ha insertado una sonda periodontal en la interfaz diente/encía y así se abrió una “bolsa gingival” hasta el nivel aproximado de la unión cementoadamantina. Después de completada la erupción dentaria, el margen gingival libre se ubica sobre la superficie del esmalte, entre 1,5 mm y 2 mm aproximadamente en sentido coronario desde el nivel de la unión cementoadamantina. Fig. 1-8 La forma de la encía interdental (la papila interdental) está determinada por la relación de contacto entre los dientes, el ancho de las superficies dentarias proximales y el recorrido de la unión cementoadamantina. En las regiones anteriores de la dentadura, la papila interdental tiene forma piramidal (Fig. 1-8b), mientras que en la región de los molares, las papilas son más aplanadas en sentido vestibulolingual (Fig. 1-8a). A causa de la presencia de las papilas interdentales, el margen gingival libre sigue un curso festoneado, más o menos acentuado, a lo largo de los dientes.
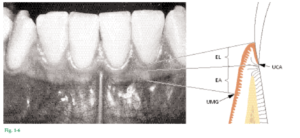


Fig. 1-9 En las regiones premolares y molares los dientes adyacentes tienen superficies de contacto en lugar de puntos de contacto (Fig. 1-9a). Debido a que la papila interdental está configurada según el contorno de las superficies de contacto interdental, en las regiones premolares y molares se forma una concavidad en forma de silla de montar (col), como se aprecia en la figura 1-9b, donde el diente distal fue extraído. Por consiguiente, en estas áreas las papilas interdentales tienen a menudo una porción vestibular (VP) y una porción lingual/palatina (LP) separadas por esta concavidad que, como lo demuestra el corte histológico (Fig. 1-9c), está cubierta por un epitelio delgado no queratinizado (flechas). Éste posee muchas características en común con el epitelio de unión (véase Fig. 1-34). Fig. 1-10 La encía adherida está delimitada en sentido coronal por la línea de la encía libre (GG) o, cuando no está presente esa línea, por un plano horizontal situado a nivel de la unión cementoadamantina. En exámenes clínicos se observó que la línea de la encía libre sólo está presente en 30-40% de los adultos.
La línea de la encía libre es a menudo más pronunciada en la cara vestibular de los dientes y se observa con mayor frecuencia en las regiones de los molares inferiores y de los premolares superiores. La encía adherida se extiende en sentido apical hasta la unión mucogingival (flechas), desde donde se continúa con la mucosa alveolar (de revestimiento) (AM). La encía adherida es de textura firme, de color rosado coralino y a veces presenta pequeñas depresiones en su superficie. Las depresiones, denominadas “punteado”, le dan aspecto de cáscara de naranja. Está adherida firmemente al hueso alveolar subyacente y al cemento por fibras del tejido conjuntivo y por esa razón es comparativamente inmóvil en relación con el tejido subyacente. Por otra parte, la mucosa alveolar, de color más oscuro y de localización apical con respecto a la unión mucogingival, está vinculada laxamente al hueso subyacente. Por consiguiente, a diferencia de la encía adherida, la mucosa alveolar es movible en relación con el tejido subyacente.
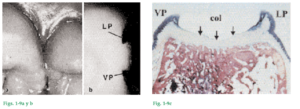

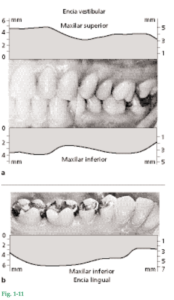
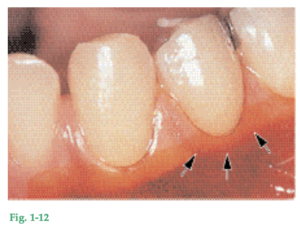
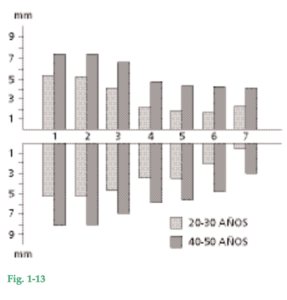
Fig. 1-11 Se observa cómo varía el ancho de la encía en diferentes partes de la boca. En el maxilar superior (Fig. 1-11a), la encía vestibular suele ser más ancha en el área de los incisivos y más angosta en adyacencias de los premolares. En el maxilar inferior (Fig. 1-11b), la encía de la cara lingual es particularmente angosta en el área de los incisivos y en la región de los molares es ancha. La variación oscila entre 1 mm y 9 mm. Fig. 1-12 Fotografía en que se ve un área de premolares inferiores donde la encía es sumamente angosta. Las flechas indican la ubicación de la unión mucogingival. La mucosa ha sido teñida con una solución yodada a efectos de diferenciar en forma más precisa entre encía y mucosa alveolar. Fig. 1-13 Esquema que ilustra el resultado de un estudio en el cual se midió la anchura de la encía adherida y se la relacionó con la edad de los pacientes examinados. Se observó que en las personas de 40-50 años la encía era significativamente más ancha que en las de 20-30 años. Esta observación revela que la anchura de la encía tiende a aumentar con la edad. Como la relación entre la unión mucogingival y el borde inferior de la mandíbula permanece invariable durante toda la vida, el progresivo aumento de anchura de la encía podría sugerir que los dientes erupcionan lentamente a lo largo de la vida, como resultado del desgaste oclusal.
ANATOMIA MICROSCOPICA
Anatomía microscópica Epitelio bucal Fig. 1-14a Dibujo que representa en forma esquemática un corte histológico (véase Fig. 1-14b) en el que se observa cómo está compuesta la encía y el área de contacto entre la encía y el esmalte (E).
Fig. 1-14b La encía libre comprende todas las estructuras epiteliales y del tejido conjuntivo (CT) situadas hacia coronal de una línea horizontal trazada a nivel de la unión cementoadamantina (CEJ). El epitelio que recubre la encía libre puede ser diferenciado de la siguiente forma: • Epitelio bucal (OE), que apunta a la cavidad bucal. • Epitelio del surco (OSE), que enfrenta al diente sin estar en contacto con la superficie del esmalte. • Epitelio de unión (JE), que provee el contacto entre la encía y el diente.
Fig. 1-14c El límite entre el epitelio bucal (OE) y el tejido conjuntivo subyacente (CT) presenta una disposición ondulada. Las porciones de tejido conjuntivo que se proyectan en el epitelio se denominan papilas de tejido conjuntivo (papilas coriales, CTP) y están separadas una de otra por crestas epiteliales llamadas papilas dérmicas (ER). En la encía normal, no inflamada, las crestas epiteliales y las papilas coriales faltan en el límite entre el epitelio de unión y su tejido conjuntivo subyacente (Fig. 1-14b). En consecuencia, la presencia de crestas epiteliales es una característica morfológica del epitelio bucal, mientras que esas estructuras están ausentes en el epitelio de unión.


Fig. 1-15 Modelo construido sobre la base de cortes histológicos seriados aumentados, que muestra la cara interna del epitelio gingival, después de haber eliminado el tejido conjuntivo. La cara interna del epitelio bucal (o subsuperficie, es decir, la superficie del epitelio que enfrenta al tejido conjuntivo) muestra varias depresiones correspondientes a las papilas del tejido conjuntivo (Fig. 1-16), que se proyectan en el epitelio. Puede verse que las proyecciones epiteliales, que en cortes histológicos separan las papilas del tejido conjuntivo, constituyen un sistema continuo de crestas epiteliales. Fig. 1-16 Modelo de tejido conjuntivo correspondiente al modelo de epitelio de la figura 1-15. El epitelio ha sido eliminado, con lo cual se tornó visible la cara vestibular del tejido conjuntivo. Nótense las papilas de tejido conjuntivo que se proyectan en el espacio que estaba ocupado por el epitelio bucal (OE) en la figura 1-15 y por el epitelio del surco (OSE) en el dorso del modelo. Fig. 1-17a En el 40% de los adultos, la encía adherida muestra un punteado en la superficie. La fotografía corresponde a un caso con punteado muy notorio (véase también Fig. 1-10).
Fig. 1-17b Vista con aumento del modelo de la superficie externa de la encía adherida. La superficie exhibe las depresiones diminutas (1-3), que cuando están presentes le dan a la encía su aspecto punteado característico. Fig. 1-17c Fotografía de la subsuperficie (superficie que enfrenta al tejido conjuntivo) del mismo modelo ilustrado en la figura 1-17b. La subsuperficie del epitelio se caracteriza por la presencia de crestas epiteliales que se fusionan en distintos sitios (1-3). Las depresiones (1-3) que se ven en la superficie externa del epitelio (Fig. 1-17b) se corresponden con los sitios de fusión (1-3) entre crestas epiteliales. Por consiguiente, las depresiones en la superficie de la encía ocurren en las áreas de fusión entre diversas crestas epiteliales.


Fig. 1-18 (a) Microfotografía de una parte del epitelio bucal que recubre la encía libre. El epitelio bucal es de tipo plano estratificado queratinizado y sobre la base del grado de diferenciación de las células productoras de queratina puede ser dividido en los siguientes estratos celulares: 1. Capa basal (estrato basal o estrato germinativo) 2. Capa de células espinosas (estrato espinoso) 3. Capa de células granulosas (estrato granuloso) 4. Capa de células queratinizadas (estrato córneo) Cabe observar que en este corte no hay núcleos en las capas celulares externas. Este tipo de epitelio se denomina ortoqueratinizado. No obstante, a menudo las células del estrato córneo del epitelio gingival humano contienen restos de núcleos (flechas), como se observa en la figura 1-18b. En este caso se dice que el epitelio es paraqueratinizado. Fig. 1-19 Además de las células productoras de queratina (queratinocitos) que constituyen alrededor del 90% de la población celular total, el epitelio bucal contiene los siguientes tipos de células:
• Melanocitos
• Células de Langerhans
• Células de Merkel
• Células inflamatorias
Estos tipos de células son a menudo de forma estrellada y poseen procesos citoplasmáticos de aspecto y dimensiones diferentes. También se las conoce como “células claras” debido a que en los cortes histológicos la zona que rodea sus núcleos aparece más clara que la que rodea a las células productoras de queratina. La microfotografía muestra células claras (flechas) situadas dentro o cerca del estrato basal del epitelio bucal. Estas células no producen queratina y carecen de uniones desmosómicas con las células adyacentes, excepto las células de Merkel. Los melanocitos son células que sintetizan pigmento y producen la Anatomía de los tejidos periodontales 11 Fig. 1-18 Fig. 1-19 pigmentación con melanina que a veces se observa en la encía. Sin embargo, todas las personas tienen melanocitos en el epitelio, independientemente de que sean de piel clara o de piel oscura. Se cree que las células de Langerhans desempeñan algún papel en el mecanismo de defensa de la mucosa bucal. Según se ha afirmado, estas células reaccionan con los antígenos en proceso de penetración del epitelio. En consecuencia, se inicia una respuesta inmunitaria temprana que inhibe o impide la penetración adicional de antígenos en el tejido. Las células de Merkel tendrían función sensitiva. Fig. 1-20 Las células del estrato basal son cilíndricas o cúbicas y están en contacto con la membrana basal que separa el epitelio del tejido conjuntivo. Las células basales poseen la capacidad de dividirse, es decir, de reproducirse por división celular mitótica. Las células señaladas con flechas en la microfotografía están en proceso de división. El epitelio se renueva en el estrato basal; por eso, también se lo denomina estrato germinativo, y se lo puede considerar el compartimiento de células progenitoras del epitelio.
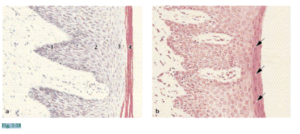
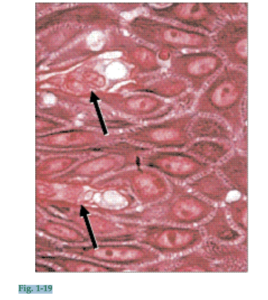
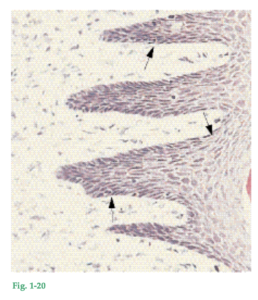
Fig. 1-21 Cuando en virtud de la reproducción celular se han formado dos células hijas (CH), una célula basal adyacente “senil” (CBS) es empujada hacia el estrato espinoso y comienza a atravesar el epitelio como queratinocito. Un queratinocito demora aproximadamente un mes en arribar a la superficie externa del epitelio, donde se desprende del estrato córneo. En un tiempo determinado, la cantidad de células que se dividen en el estrato basal iguala a la cantidad de células que se desprenden en la superficie. Por ende, en circunstancias normales la renovación celular y la pérdida de células se hallan completamente en equilibrio y el epitelio mantiene un grosor constante. A medida que la célula basal migra a través del epitelio, se va aplanando y su eje mayor se orienta en forma paralela a la superficie epitelial.
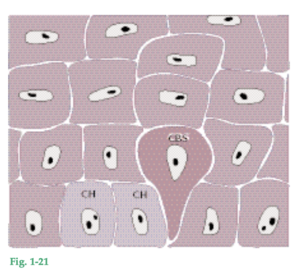
Fig. 1-22 Las células están inmediatamente adyacentes al tejido conjuntivo, del cual están separadas por la membrana basal, producida probablemente por las células basales. Con microscopia óptica, esta membrana se ve como una zona no estructurada de alrededor de 1-2 µm de espesor (flechas), con reacción positiva a la coloración con ácido peryódico de Schiff (PAS). Esta reacción positiva demuestra que la membrana basal contiene hidratos de carbono (glucoproteínas). Las células epiteliales están rodeadas por una sustancia extracelular que contiene complejos de proteínas y polisacáridos. A nivel ultraestructural, la membrana basal presenta una composición compleja.
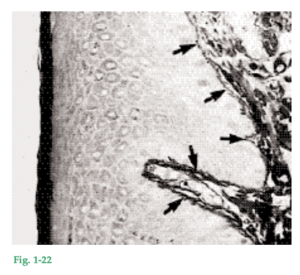
Fig. 1-23 Microfotografía electrónica (70.000×) de un área que incluye parte de una célula basal, la membrana basal y parte del tejido conjuntivo adyacente. La célula basal (BC) ocupa la porción superior de la figura. Inmediatamente por debajo de la célula basal puede verse una zona a la que atraviesan electrones, la lámina lúcida (LL), de alrededor de 400 Å de espesor. Por debajo de la lámina lúcida se halla una zona densa o impermeable a los electrones, de espesor aproximadamente igual. Esta zona se denomina lámina densa (LD). Desde la lámina densa emergen las llamadas fibras de anclaje (AF) dispuestas en forma de abanico dentro del tejido conjuntivo. Las fibras de anclaje tienen alrededor de 1 µm de longitud y terminan libremente en el tejido conjuntivo. Por consiguiente, la membrana basal que aparece como una entidad en la microscopia óptica, en la microfotografía electrónica se muestra compuesta por una lámina lúcida, una lámina densa y fibras adyacentes del tejido conjuntivo (fibras de anclaje). La membrana plasmática de las células epiteliales que enfrenta a la membrana basal aloja una cantidad de zonas electrodensas más gruesas, que aparecen con diversos intervalos a lo largo de la membrana plasmática. Estas estructuras son los hemidesmosomas (HD). Los tonofilamentos citoplasmáticos (CT) de la célula convergen hacia esos hemidesmosomas, los cuales están involucrados en la fijación del epitelio sobre la membrana basal subyacente.
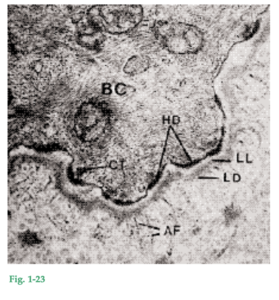
Fig. 1-24 Área de estrato espinoso en el epitelio gingival. El estrato espinoso consta de 10-20 capas de células relativamente grandes y poliédricas, provistas de procesos citoplasmáticos cortos que parecen espinas. Estos procesos citoplasmáticos (flechas) aparecen a intervalos regulares y le dan a la célula un aspecto espinoso. Junto con los complejos intercelulares de proteínas e hidratos de carbono, la cohesión entre las células es suministrada por numerosos “desmosomas” (pares de hemidesmosomas) situados entre los procesos citoplasmáticos de células adyacentes.

Fig. 1-25 Área del estrato espinoso en una microfotografía electrónica. Las estructuras oscuras entre las células epiteliales representan los desmosomas (flechas). Un desmosoma puede ser considerado como dos hemidesmosomas enfrentados. La presencia de una gran cantidad de desmosomas indica que la cohesión entre las células epiteliales es sólida. La célula clara (LC) en el centro de la ilustración no alberga hemidesmosomas y por consiguiente, no se trata de un queratinocito sino de una “célula clara” (véase también Fig. 1-19).

Fig. 1-26 Dibujo esquemático de la composición de un desmosoma. Un desmosoma puede ser considerado compuesto por dos hemidesmosomas adyacentes, separados por una zona que contiene material granuloso electrodenso (MGE). Por lo tanto, un desmosoma comprende los siguientes componentes estructurales: 1) las hojuelas externas (HE) de la membrana plasmática de dos células adyacentes, 2) las gruesas hojuelas internas (HI) de las membranas plasmáticas y 3) las placas de inserción (PI), que representan material granuloso y fibrilar en el citoplasma.

Fig. 1-27 Como ya se mencionó, el epitelio bucal también contiene melanocitos, responsables de la producción del pigmento melanina. Los melanocitos están presentes en individuos con pigmentación acentuada de la mucosa bucal pero también en quienes no muestran signos clínicos de pigmentación. En esta microfotografía electrónica hay un melanocito (MC) en la porción inferior del estrato espinoso. Esta célula, a diferencia del queratinocito, contiene gránulos de melanina (MG) y carece de tonofilamentos y hemidesmosomas. Nótese la gran cantidad de tonofilamentos en el citoplasma de los queratinocitos adyacentes.
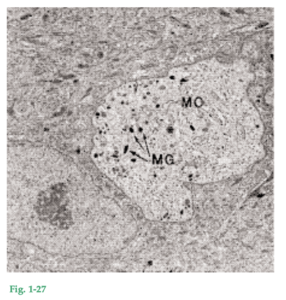
Fig. 1-28 Al atravesar el epitelio desde la capa basal hasta la superficie epitelial, los queratinocitos experimentan diferenciación y especialización continua. Los numerosos cambios que ocurren durante este proceso están indicados en este dibujo de un epitelio plano estratificado queratinizado. Desde la capa basal (estrato basal) hasta la capa granulosa (estrato granuloso) aumentan el número de tonofilamentos (TF) en el citoplasma y la cantidad de desmosomas (D). Por el contrario, la cantidad de orgánulos como las mitocondrias (M), laminillas de retículo endoplasmático rugoso (RER) y complejos de Golgi (CG) disminuye en el queratinocito en su recorrido desde la capa basal hasta la superficie epitelial. En el estrato granuloso hay cuerpos electrodensos de queratohialina (CQ) y grupos de gránulos con glucógeno. Se cree que esos gránulos se relacionan con la síntesis de queratina.
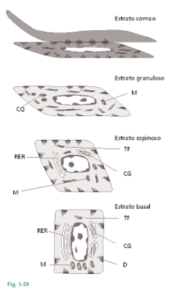
Fig. 1-29 Microfotografía del estrato granuloso y del estrato córneo. En el estrato granuloso se ven gránulos de queratohialina (flechas). Hay una transición abrupta de las células del estrato granuloso al estrato córneo. Esto indica una queratinización muy súbita del citoplasma de los queratinocitos y su conversión en una escama córnea. El citoplasma de las células del estrato córneo (SC) está lleno de queratina y se ha perdido todo el aparato para la síntesis de proteínas y la producción de energía, es decir, el núcleo, las mitocondrias, el retículo endoplasmático y el complejo de Golgi. Empero, en un epitelio paraqueratinizado las células del estrato córneo contienen remanentes de sus núcleos. La queratinización se considera un proceso de diferenciación, no de degeneración. Es un proceso de síntesis proteica que requiere energía y depende de células funcionales, esto es, células que contienen un núcleo y un conjunto normal de orgánulos. Resumen: En su paso desde el estrato basal hasta la superficie del epitelio, el queratinocito experimenta diferenciación continua. Por ello, una vez que el queratinocito se separa de la membrana basal ya no se puede dividir, pero conserva la capacidad de producir proteínas (tonofilamentos y gránulos de queratohialina). En el estrato granuloso el queratinocito pierde su aparato productor de energía y de proteínas (probablemente por degradación enzimática) y se transforma de manera abrupta en una célula llena de queratina que por vía del estrato córneo se exfolia de la superficie epitelial.
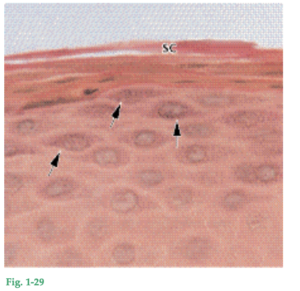
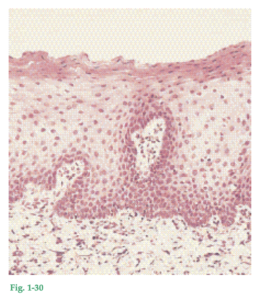
Fig. 1-30 Porción del epitelio de la mucosa alveolar (de revestimiento). A diferencia del epitelio de la encía, la mucosa de revestimiento no posee estrato córneo. Nótese que pueden identificarse células nucleadas en todas las capas, desde la basal hasta la superficie del epitelio.
Epitelio dentogingival Los componentes hísticos de la región dentogingival alcanzan sus características estructurales definitivas en forma simultánea con la erupción de los dientes. La figura 1-31a-d ilustra este hecho. Fig. 1-31a Cuando el esmalte del diente se ha desarrollado plenamente, las células productoras de esmalte (ameloblastos) reducen su altura, producen una lámina basal y forman, junto con células del epitelio externo del órgano del esmalte, el llamado epitelio dental reducido (ER). La lámina basal (lámina de inserción epitelial, LIE) está en contacto directo con el esmalte. El contacto entre la lámina y las células epiteliales es mantenido por hemidesmosomas. El epitelio reducido del esmalte rodea a la corona del diente desde el momento en que el esmalte se mineraliza correctamente hasta que empieza la erupción dentaria.
Fig. 1-31b A medida que el diente en erupción se acerca al epitelio bucal, las células de la capa externa del epitelio dental reducido (ER) y las células de la capa basal del epitelio bucal (EB) muestran mayor actividad mitótica (flechas) y comienzan a migrar hacia el tejido conjuntivo subyacente. El epitelio en migración produce una masa epitelial entre el epitelio bucal y el epitelio dental reducido, de modo que el diente puede erupcionar sin que haya sangrado. Los ex ameloblastos no se dividen. Fig. 1-31c Cuando el diente ya ha ingresado en la cavidad bucal, extensas zonas ubicadas en topografía inmediatamente apical al área incisal son cubiertas por un epitelio de unión (EU) que contiene sólo algunas capas de células. Sin embargo, la región cervical del esmalte todavía está cubierta de ameloblastos (AB) y células exteriores del epitelio dental reducido.
Fig. 1-31d Durante las últimas fases de la erupción dental, todas las células del epitelio reducido del esmalte son reemplazadas por un epitelio de unión (EU). Éste se continúa con el epitelio bucal y provee la fijación entre el diente y la encía. Si se reseca la encía libre después de la erupción completa del diente, durante la cicatrización se desarrolla un nuevo epitelio de unión, indiferenciable del que se halla después de la erupción del diente. El hecho de que este nuevo epitelio de unión se haya desarrollado del epitelio bucal indica que las células de este epitelio poseen la capacidad de diferenciarse en células del epitelio de unión.
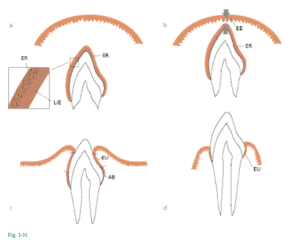
Fig. 1-32 Corte histológico a través del área limítrofe entre el diente y la encía, es decir, la región dentogingival. El esmalte (E) está a la izquierda y hacia la derecha se ven el epitelio de unión (JE), el epitelio del surco (OSE) y el epitelio bucal (OE). El epitelio del surco recubre el poco profundo surco gingival, situado entre el esmalte y la parte superior de la encía libre. Desde el punto de vista morfológico, el epitelio de unión difiere del epitelio del surco y del epitelio bucal, mientras que estos dos últimos son muy similares entre sí. Aunque puede existir variación individual, el epitelio de unión por lo general es más ancho en su porción coronal (unas 15-20 capas de células) y se adelgaza (3-4 células de espesor) hacia la unión cementoadamantina (CEJ). El límite entre el epitelio de unión y el tejido conjuntivo subyacente no presenta crestas epiteliales, excepto cuando está inflamada.

Fig. 1-33 El epitelio de unión tiene una superficie libre en el fondo del surco gingival (GS). Al igual que el epitelio del surco y el epitelio bucal, el epitelio de unión se renueva continuamente mediante división celular en la capa basal. Las células migran hacia la base del surco gingival, donde se desprenden. El límite entre epitelio de unión (JE) y epitelio del surco (OSE) se indica con flechas. Las células del epitelio del surco son cúbicas y la superficie de este epitelio está queratinizada.
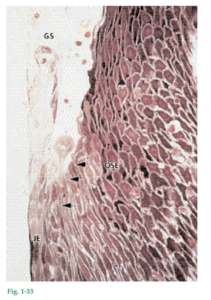
Fig. 1-34 Imágenes que muestran diferentes características del epitelio de unión. En la figura 1-34a se observa que las células del epitelio de unión (JE) se disponen en una capa basal (BL) y varias capas suprabasales (SBL). La figura 1-34b demuestra que las células basales y las suprabasales son aplanadas, con su eje mayor paralelo a la superficie del diente. (CT: tejido conjuntivo, E: espacio del esmalte). Existen claras diferencias entre el epitelio del surco, el epitelio bucal y el epitelio de unión: 1. En relación con el volumen tisular, el tamaño de las células del epitelio de unión es mayor que en el epitelio bucal. 2. En relación con el volumen tisular, los espacios intercelulares del epitelio de unión son comparativamente mayores que los del epitelio bucal. 3. La cantidad de desmosomas es menor en el epitelio de unión que en el epitelio bucal. Nótense los espacios intercelulares comparativamente amplios entre las células oblongas del epitelio de unión y la presencia de dos granulocitos neutrófilos (PMN) que atraviesan el epitelio. El área del recuadro (A) aparece con mayor aumento en la figura 1-34c; puede observarse que las células del epitelio de unión no están en contacto directo con el esmalte (E). Entre el esmalte y el epitelio de unión (JE) puede verse una zona electrodensa (1) y una zona electrolúcida (2). La zona electrolúcida está en contacto con las células del epitelio de unión (JE). Estas dos zonas tienen una estructura muy similar a la de la lámina densa (LD) y la lámina lúcida (LL) en el área de la membrana basal (esto es, la interfaz entre epitelio [JE] y tejido conjuntivo [CT]) descrita en la figura 1-23. Asimismo, la membrana plasmática de las células del epitelio de unión contiene hemidesmosomas (HD) orientados hacia el esmalte y hacia el tejido conjuntivo. Por ende, la interfaz entre esmalte y epitelio de unión es similar a la interfaz entre epitelio y tejido conjuntivo.
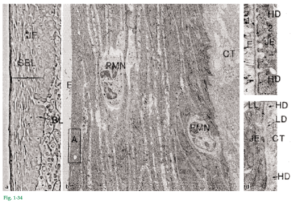
Fig. 1-35 Dibujo esquemático de la célula del epitelio de unión ubicada más apicalmente. El esmalte (E) está a la izquierda del dibujo. Puede observarse que la zona electrodensa (1) entre el epitelio de unión y el esmalte representa una continuación de la lámina densa (LD) de la membrana basal en el lado del tejido conjuntivo. De manera similar, la zona electrolúcida (2) puede considerarse una continuación de la lámina lúcida (LL). Sin embargo, nótese que a diferencia de la interfaz epitelio-tejido conjuntivo, no hay fibras de anclaje (FA) fijadas a la estructura similar a la lámina densa (1) adyacente al esmalte. Por otra parte, al igual que las células basales adyacentes a la membrana basal (en la interfaz del tejido conjuntivo), las células del epitelio de unión que enfrentan a la estructura similar a la lámina lúcida (2) albergan hemidesmosomas (HD). Por consiguiente, la interfaz entre el epitelio de unión y el esmalte es muy similar, desde el punto de vista estructural, a la interfaz epitelio-tejido conjuntivo, lo cual significa que el epitelio de unión no sólo está en contacto con el es malte, sino que realmente está fijado al diente por medio de hemidesmosomas. Lámina propia El componente tisular predominante en la encía es el tejido conjuntivo (lámina propia o corion). Los componentes principales del tejido conjuntivo son: fibras colágenas (alrededor del 60% del volumen del tejido conjuntivo), fibroblastos (alrededor del 5%), vasos y nervios (aproximadamente 35%) incluidos en sustancia fundamental amorfa (matriz).

Fig. 1-36 Dibujo que representa un fibroblasto (F) ubicado dentro de una red de fibras del tejido conjuntivo (FTC). El espacio entre estos elementos está ocupado por la matriz (Ma), que constituye el “medioambiente” de la célula. Células Los distintos tipos de células presentes en el tejido conjuntivo son: 1) fibroblastos, 2) mastocitos, 3) macrófagos y 4) células inflamatorias.
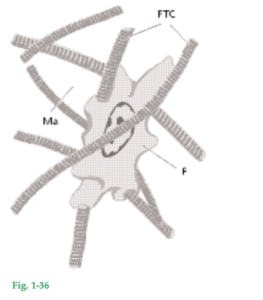
Fig. 1-37 El fibroblasto es la célula predominante en el tejido conjuntivo (65% del total de la población celular). El fibroblasto se ocupa de la producción de los diversos tipos de fibras que se hallan en el tejido conjuntivo, pero también interviene en la síntesis de la matriz del tejido conjuntivo. El fibroblasto es una célula de forma ahusada o estrellada con núcleo ovalado que contiene uno o más nucléolos. En la foto grafía obtenida con magnificación por microscopia electrónica se ve parte de un fibroblasto. El citoplasma contiene un retículo endoplasmático rugoso bien desarrollado (E) con ribosomas. El complejo de Golgi (G) por lo general es de dimensiones considerables y las mitocondrias (M) son grandes y numerosas. Además, el citoplasma contiene muchos tonofilamentos finos (F). Junto a la membrana plasmática a lo largo de la periferia de lacélula se halla una gran cantidad de vesículas (V).
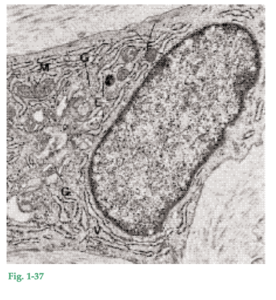
Fig. 1-38 El mastocito es responsable de la producción de algunos componentes de la matriz. Esta célula produce también sustancias vasoactivas, que pueden afectar la función del sistema microvascular y controlar el flujo de sangre a través del tejido. La microfotografía electrónica muestra un mastocito con gran aumento. El citoplasma se caracteriza por la presencia de una gran cantidad de vesículas (V) de diverso tamaño. Estas vesículas contienen sustancias biológicamente activas, como enzimas proteolíticas, histamina y heparina. El complejo de Golgi (G) está bien desarrollado, mientras que el retículo endoplasmático rugoso es poco abundante. A lo largo de la periferia de la célula puede verse gran cantidad de pequeñas proyecciones citoplasmáticas, las microvellosidades (MV).

Fig. 1-39 El macrófago tiene en el tejido diferentes funciones fagocíticas y de síntesis. La microfotografía electrónica muestra un macrófago. El núcleo se caracteriza por numerosas invaginaciones de distinto tamaño. En la periferia del núcleo puede verse una zona de condensaciones electrodensas de cromatina. El complejo de Golgi (G) está bien desarrollado y en el citoplasma se encuentran numerosas vesículas (V) de distinto tamaño. El retículo endoplasmático rugoso (E) es escaso, pero en el citoplasma hay cierta cantidad de ribosomas libres (R) distribuidos uniformemente. En vesículas lisosómicas se encuentran a menudo restos de material fagocitado: son los fagosomas (PH). En la periferia de la célula hay numerosas microvellosidades de diversos tamaños. Los macrófagos son particularmente numerosos en los tejidos inflamados. Estas células derivan de monocitos de la sangre circulante que migran hacia los tejidos.
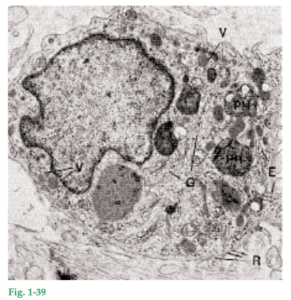
Fig. 1-40 Además de fibroblastos, mastocitos y macrófagos, el tejido conjuntivo tiene también células inflamatorias de distintos tipos, por ejemplo, granulocitos neutrófilos, linfocitos y plasmocitos. Los granulocitos neutrófilos, también denominados leucocitos polimorfonucleares, tienen un aspecto característico (Fig. 1-40a). El núcleo es lobulado y en el citoplasma se encuentran numerosos lisosomas (L) que contienen enzimas lisosómicas. Los linfocitos (Fig. 1-40b) se caracterizan por un núcleo oval o esférico que contiene áreas localizadas de cromatina electrodensa. El estrecho borde de citoplasma que rodea al núcleo contiene numerosos ribosomas libres, unas pocas mitocondrias (M) y en algunas áreas, retículo endoplasmático con ribosomas fijos. El citoplasma también posee lisosomas. Los plasmocitos (Fig. 1-40c) contienen un núcleo esférico excéntrico, con cromatina electrodensa dispuesta en forma radiada. En el citoplasma, distribuido en forma aleatoria, se halla el retículo endoplasmático (E) con numerosos ribosomas. El citoplasma contiene también numerosas mitocondrias (M) y un complejo de Golgi bien desarrollado. Fibras Las fibras del tejido conjuntivo son producidas por los fibroblastos y pueden clasificarse en: 1) fibras colágenas, 2) fibras de reticulina, 3) fibras de oxitalano y 4) fibras elásticas.
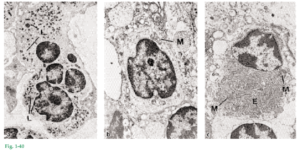
Fig. 1-41 Las fibras colágenas son las predominantes en el tejido conjuntivo gingival y constituyen el componente esencial del periodonto. La microfotografía electrónica muestra cortes transversales y longitudinales de fibras colágenas. Las fibras colágenas tienen un bandeado transversal característico, con intervalos de 700 Å entre las bandas oscuras.

Fig. 1-42 Características importantes de la síntesis y la composición de las fibras colágenas producidas por fibroblastos (F). La unidad más pequeña, es decir, la molécula de colágeno, a menudo es denominada tropocolágeno. En la parte superior del dibujo se ve una molécula de tropocolágeno (tc), que tiene unos 3.000 Å de longitud y 15 Å de diámetro. Consta de tres cadenas de polipéptidos entrelazadas en forma helicoidal. Cada cadena contiene cerca de 1.000 aminoácidos. Un tercio de éstos son moléculas de glicina y alrededor del 20% corresponden a prolina e hidroxiprolina; este último aminoácido prácticamente sólo se encuentra en el colágeno. La síntesis de tropocolágeno ocurre dentro del fibroblasto, desde donde la molécula de tropocolágeno es segregada hacia el espacio extracelular. Luego, la polimerización de las moléculas de tropocolágeno para formar fibras colágenas ocurre en el compartimiento extracelular. Primero, las moléculas de tropocolágeno se agrupan longitudinalmente formando protofibrillas (pf); después éstas se agrupan lateralmente, en disposición paralela, para constituir fibrillas colágenas (fc) con alrededor del 25% de solapamiento longitudinal de las moléculas de tropocolágeno. Como consecuencia de las condiciones especiales de refracción que se desarrollan en los sitios de superposición de las moléculas de tropocolágeno después de la tinción, en la microscopia óptica se observa un bandeado transversal a intervalos de alrededor de 700 Å. Las fibras colágenas (FC) son haces de fibrillas colágenas alineadas de forma que las fibras también muestran un bandeado transversal a intervalos de 700 Å. En el tejido, las fibras suelen agruparse en haces. Cuando las fibras colágenas maduran se forman entrecruzamientos covalentes entre las moléculas de tropocolágeno, cuyo resultado es la reducción de la solubilidad del colágeno, asociada con el envejecimiento. Los cementoblastos y los osteoblastos tienen también capacidad de producir colágeno.
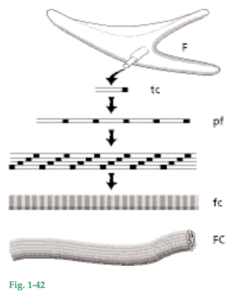
Fig. 1-43 Las fibras de reticulina como las de esta microfotografía, son argirófilas y abundan en las partes del tejido adyacentes a la membrana basal (flechas). No obstante, las fibras de reticulina también están en gran cantidad en el tejido conjuntivo laxo que rodea a los vasos sanguíneos. Por consiguiente, las fibras de reticulina están presentes en las interfaces tejido conjuntivo-epitelio y endotelio-tejido conjuntivo.

Fig. 1-44 Las fibras de oxitalano son escasas en la encía pero abundantes en el ligamento periodontal. Están formadas por fibrillas largas y delgadas con un diámetro aproximado de 150 Å. Estas fibras del tejido conjuntivo pueden verse con microscopia óptica sólo después de una oxidación con ácido peracético. La microfotografía ilustra las fibras de oxitalano (flechas) en el ligamento periodontal, donde tienen un recorrido principalmente paralelo al eje mayor del diente. La función de estas fibras todavía se desconoce. A la izquierda se ve el cemento y a la derecha, el hueso alveolar.

Fig. 1-45 En el tejido conjuntivo de la encía y el ligamento periodontal las fibras elásticas sólo se hallan asociadas a los vasos sanguíneos. No obstante, como se observa en esta microfotografía, la lámina propia y la submucosa de la mucosa alveolar (de revestimiento) contienen numerosas fibras elásticas (flechas). La encía (G) de localización coronal con respecto a la unión mucogingival (MGJ) no contiene fibras elásticas, excepto las que se asocian con los vasos sanguíneos.
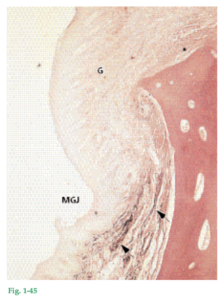
Fig. 1-46 Aunque muchas de las fibras colágenas gingivales y del ligamento periodontal están distribuidas en forma irregular o aleatoria, la mayoría tienden a estar dispuestas en grupos de haces con una orientación definida. De acuerdo con su inserción y trayectoria en el tejido, los haces orientados de la encía pueden clasificarse en los siguientes grupos: 1. Fibras circulares (FCir), que son haces de fibras que transcurren por la encía libre y circundan al diente en forma de manguito o de anillo. 2. Fibras dentogingivales (FDG), que están incluidas en el cemento de la porción supralveolar de la raíz y se proyectan desde el cemento, en forma de abanico, hasta el tejido gingival de las superficies vestibular, lingual e interproximales. 3. Fibras dentoperiósticas (FDP), que están incluidas en la misma porción de cemento que las fibras dentogingivales, pero transcurren en dirección apical sobre la cresta ósea vestibular y lingual y terminan en el tejido de la encía adherida. En el área limítrofe entre la encía libre y la encía adherida, a menudo el epitelio carece del soporte de los haces de fibras colágenas orientadas subyacentes. En esta área suele observarse la línea de la encía libre (LEL). 4. Fibras transeptales (FT), que aparecen en el dibujo a la derecha; se extienden entre el cemento supralveolar de dientes contiguos. Las fibras transeptales tienen un recorrido recto por sobre el tabique interdental y están incluidas en el cemento de dientes adyacentes.

Fig. 1-47 Corte histológico que ilustra la orientación de los haces de fibras transeptales (flechas) en la porción supralveolar del área interdental. Nótese que además de conectar el cemento de dientes adyacentes (C), las fibras transeptales también conectan el cemento supralveolar (C) con la cresta del hueso alveolar (AB). Los cuatro grupos de haces de fibras colágenas presentadas en la figura 1-46 refuerzan la encía y proveen elasticidad y firmeza, necesarias para mantener su conformación arquitectónica y la integridad de la inserción dentogingival. Matriz La matriz del tejido conjuntivo es producida principalmente por los fibroblastos, aunque algunos componentes son producidos por los mastocitos y otros derivan de la sangre. La matriz es el medio en el cual están incluidas las células del tejido conjuntivo y es esencial para el desarrollo normal de sus funciones tisulares. Dentro de la matriz se produce el transporte de agua, electrolitos, nutrientes, metabolitos, etc., desde las células del tejido conjuntivo y hacia él. Los componentes principales de la matriz del tejido conjuntivo son complejos macromoleculares de proteínas e hidratos de carbono. Estos complejos se clasifican generalmente en proteoglucanos y glucoproteínas. Como unidades de hidratos de carbono, los proteoglucanos contienen glucosaminoglucanos (hialuronano sulfato, heparansulfato, etc.) que, por vía de enlaces covalentes están unidas a una o más cadenas proteicas. El componente carbohidrato siempre predomina en los proteoglucanos. El glucosaminoglucano llamado hialuronano o “ácido hialurónico” probablemente no está unido a proteínas. Las glucoproteínas (fibronectina, osteonectina, etc.) también contienen polisacáridos, pero esas macromoléculas son diferentes de los glucosaminoglucanos. El componente proteico predomina en las glucoproteínas. En las macromoléculas, los monosacáridos u oligosacáridos están conectados con una o más cadenas de proteínas mediante enlaces covalentes.
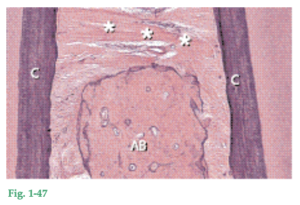
Fig. 1-48 La actividad normal del tejido conjuntivo depende de la presencia de proteoglucanos y glucosaminoglucanos. El componente carbohidrato de los proteoglucanos, los glucosaminoglucanos ( ), está constituido por moléculas de cadenas grandes y flexibles con carga negativa, cada una de las cuales ocupa un espacio bastante grande (Fig. 1-48a). En ese espacio pueden ser incorporadas moléculas más pequeñas, por ejemplo, agua y electrolitos, mientras que las moléculas más grandes no pueden ingresar (Fig. 1-48b). De esta forma, los proteoglucanos regulan la difusión y el flujo de líquidos a través de la matriz y son determinantes del contenido líquido del tejido y del mantenimiento de la presión osmótica. En otras palabras, los proteoglucanos actúan como un filtro molecular y además desempeñan un papel importante en la regulación de la migración (movimiento) celular en el tejido. A causa de su estructura e hidratación, las macromoléculas muestran resistencia a la deformación, por lo cual sirven para regular la consistencia del tejido conjuntivo (Fig. 1-48c). Si se comprime la encía, las macromoléculas se deforman y cuando se elimina la presión, las macromoléculas recuperan su forma original. Por estas razones, las macromoléculas son importantes para la elasticidad de la encía.
Interacción epiteliomesenquimática Existen varios ejemplos del hecho de que durante el desarrollo embrionario de diversos órganos se produce una influencia inductora mutua entre epitelio y tejido conjuntivo. El desarrollo de los dientes es un ejemplo característico de este fenómeno. Por una parte, el tejido conjuntivo es un factor determinante para el desarrollo normal del germen dentario y por otra, el epitelio del esmalte ejerce una influencia definida en el desarrollo de los componentes mesenquimáticos del diente. Se piensa que la diferenciación tisular en el organismo adulto puede ser influida por factores ambientales. Por ejemplo, la piel y las mucosas exhiben a menudo aumento de queratinización e hiperplasia del epitelio en áreas expuestas a estimulación mecánica. Por lo tanto, los tejidos parecen adaptarse a los estímulos ambientales. Se considera que la presencia de epitelio queratinizado en la mucosa masticatoria representa la adaptación a la irritación mecánica generada por la masticación. Sin embargo, las investigaciones demostraron que los rasgos característicos del epitelio en esas áreas están determinados genéticamente. A continuación se formulan algunas observaciones al respecto.
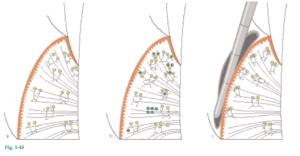
Fig. 1-49 Mediante un procedimiento quirúrgico se realizó en un mono una transposición entre la encía (G) y la mucosa alveolar (AM). La mucosa alveolar fue ubicada en estrecho contacto con los dientes, mientras que la encía fue aplicada en el área de la mucosa alveolar.
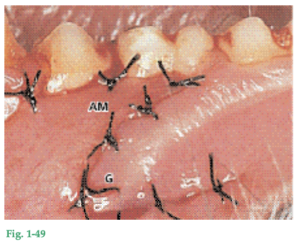
Fig. 1-50 Imagen de la misma área de la figura 1-49, 4 meses más tarde. A pesar de que la encía trasplantada (G) es movible en relación con el hueso subyacente, al igual que la mucosa alveolar, ha conservado sus rasgos morfológicos característicos de mucosa masticatoria. Sin embargo, una estrecha zona de encía queratinizada nueva (NG) se ha regenerado entre la mucosa alveolar trasplantada (AM) y los dientes.

Fig. 1-51 Corte histológico que atraviasa la encía trasplantada de la figura 1-50. Como no hay fibras elásticas en el tejido conjuntivo gingival (G), pero ellas son abundantes (flechas pequeñas) en el tejido conjuntivo de la mucosa alveolar (AM), el tejido gingival trasplantado puede identificarse con facilidad. El epitelio que recubre el tejido gingival trasplantado muestra una capa de queratina bien definida (ubicada entre las flechas grandes) en la superficie y también la configuración de la interfaz epitelio-tejido conjuntivo (es decir, crestas epiteliales y papilas de tejido conjuntivo) es similar a la de la encía normal no trasplantada. Por consiguiente, el tejido gingival en ubicación heterotópica ha conservado su especificidad original. Esta observación demuestra que las características de la encía están determinadas genéticamente en lugar de ser el resultado de la adaptación funcional a estímulos ambientales.
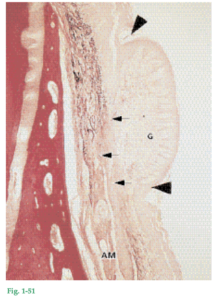
Fig. 1-52 Corte histológico que corresponde a la porción coronaria del área de trasplante (que se muestra en la figura 1-50). En la parte inferior de la microfotografía se observa el tejido gingival trasplantado (G) de la figura 1-51. El trasplante de mucosa alveolar (AM) se advierte entre las dos flechas grandes, hacia el centro de la ilustración. Después de la intervención quirúrgica, el trasplante de mucosa alveolar fue ubicado en contacto íntimo con los dientes, como se ve en la figura 1-49. Después de la curación se desarrolló una zona angosta de encía queratinizada (NG) en dirección coronal con respecto al trasplante de mucosa alveolar (véase Fig. 1-50). Esta nueva zona gingival (NG) que puede verse en la porción superior del corte histológico, está recubierta de epitelio queratinizado y el tejido conjuntivo no contiene fibras elásticas, que se tiñen de color violeta. Además, es importante advertir que el límite entre los epitelios queratinizado y no queratinizado (flechas grandes) se corresponde exactamente con la unión entre tejido conjuntivo “elástico” y “no elástico” (flechas pequeñas). El tejido conjuntivo de la encía nueva se ha regenerado a partir del tejido conjuntivo de los compartimientos supralveolar y del ligamento periodontal y ha separado del diente al trasplante de mucosa alveolar (AM) (véase Fig. 1-53). En cambio, es probable que el epitelio que recubre la encía nueva haya migrado desde el epitelio adyacente de la mucosa alveolar.
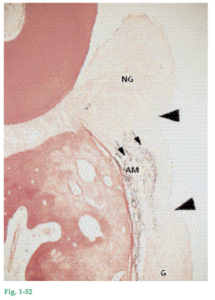
Fig. 1-53 Dibujo que representa en forma esquemática el desarrollo de la nueva y estrecha zona de encía queratinizada (EQ) ilustrada en las figuras 1-50 y 1-52. Fig. 1-53a El tejido de granulación ha proliferado en dirección coronal, junto a la superficie radicular (flecha) y ha separado el trasplante de mucosa alveolar (MA) de su contacto original con la superficie dental. (TG, trasplante gingival). Fig. 1-53b Las células epiteliales han migrado desde el trasplante de mucosa alveolar (MA) hasta el tejido conjuntivo gingival neoformado (GN). De este modo, la encía recién formada ha quedado recubierta por epitelio queratinizado (EQ) originado en el epitelio no queratinizado de la mucosa alveolar (MA). Esto implica que el tejido conjuntivo nuevo formado (GN) posee la capacidad de inducir cambios en la diferenciación del epitelio originado de la mucosa alveolar. Este epitelio, que por lo general es no queratinizado, aparentemente se diferencia en epitelio queratinizado por estímulos que surgen del tejido conjuntivo neoformado (GN). (TG, trasplante gingival).
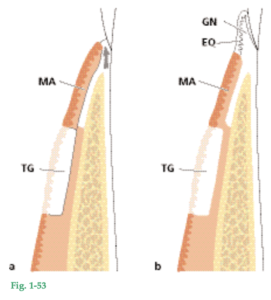
Fig. 1-54 Porción de tejido conjuntivo gingival (G) y de tejido conjuntivo de la mucosa alveolar (AM), que después del trasplante ha cicatrizado en las áreas lesionadas de la mucosa alveolar. La epitelización de estos trasplantes sólo puede producirse mediante la migración de células epiteliales de la mucosa alveolar circundante.

Fig. 1-55 Tejido conjuntivo gingival trasplantado (G) después de la reepitelización. Esta porción tisular adquirió un aspecto similar al de la encía normal, lo que indica que este tejido conjuntivo está ahora recubierto por epitelio queratinizado. El tejido conjuntivo trasplantado de la mucosa alveolar (AM) está recubierto por epitelio no queratinizado y tiene el mismo aspecto que la mucosa alveolar circundante.
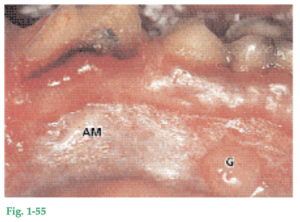
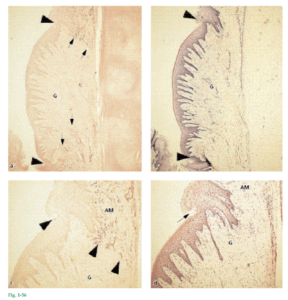
Fig. 1-56 Dos cortes histológicos que muestran el área de tejido conjuntivo gingival trasplantado. El corte de la figura 1-56a ha sido teñido para poner en evidencia las fibras elásticas (flechas). El tejido del centro, que carece de fibras elásticas, es el tejido conjuntivo gingival trasplantado (G). La figura 1-56b muestra un corte adyacente teñido con hematoxilina y eosina. En la comparación de las figura 1-56a y 1- 56b se notará que: 1. El tejido conjuntivo gingival trasplantado está recubierto por epitelio queratinizado (entre puntas de flechas). 2. La interfaz del epitelio y el tejido conjuntivo tiene la misma distribución ondulante (es decir, con crestas epiteliales y papilas de tejido conjuntivo) que la que se observa en la encía normal. Las microfotografías de las figuras 1-56c y 1-56d ilustran con mayor aumento el área limítrofe entre la mucosa alveolar (AM) y el tejido conjuntivo gingival trasplantado (G). Nótese la nítida relación entre el epitelio queratinizado (flecha) y el tejido conjuntivo “no elástico” (puntas de flecha) y entre el epitelio no queratinizado y el tejido conjuntivo “elástico”. El establecimiento de esta estrecha relación durante la cicatrización implica que el tejido conjuntivo gingival trasplantado posee la capacidad de alterar la diferenciación de células epiteliales, como ya se señaló (Fig. 1-53). Las células del epitelio de la mucosa alveolar pasaron de no queratinizadas a notoriamente queratinizadas. Esto significa que la especificidad del epitelio está determinada por factores genéticos inherentes al tejido conjuntivo.
Ligamento periodontal
El ligamento periodontal es el tejido blando altamente vascularizado y celular que rodea las raíces de los dientes y conecta el cemento radicular con la pared del alvéolo. En sentido coronal, el ligamento periodontal se continúa con la lámina propia de la encía y está delimitado respecto de ella por los haces de fibras colágenas que conectan la cresta ósea alveolar con la raíz (las fibras de la cresta alveolar). Fig. 1-57 Radiografía de una región de premolares y molares inferiores. En las radiografías pueden diferenciarse dos tipos de hueso alveolar: 1. La parte del hueso alveolar que recubre el alvéolo, denominada “lámina dura” (flechas). 2. La porción de la apófisis alveolar que en la radiografía tiene un aspecto de entramado es el “hueso esponjoso”.
El ligamento periodontal se ubica en el espacio situado entre las raíces dentales (R) y la lámina dura o el hueso alveolar propiamente dicho (flechas). El hueso alveolar (AB) rodea al diente hasta un nivel situado en dirección apical a aproximadamente 1 mm de la unión cementoadamantina (CEJ). El borde coronal del hueso se denomina cresta alveolar (flechas). El espacio para el ligamento periodontal tiene la forma de un reloj de arena y es más angosto a nivel del centro de la raíz. El espesor del ligamento periodontal es de 0,25 mm aproximadamente (entre 0,2 y 0,4 mm). La presencia de un ligamento periodontal permite que las fuerzas generadas durante la función masticatoria y otros contactos dentarios se distribuyan sobre la apófisis alveolar y sean absorbidas por ésta mediante el hueso alveolar propiamente dicho. El ligamento periodontal también es esencial para la movilidad de los dientes. La movilidad dental está determinada en buena medida por el espesor, la altura y la calidad del ligamento periodontal (véanse Capítulos 14 y 51).
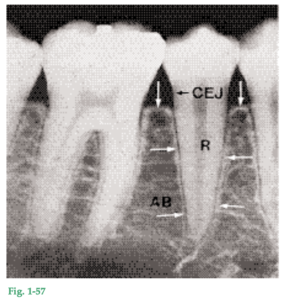
Fig. 1-58 Esquema de la localización del ligamento periodontal situado entre el hueso alveolar propiamente dicho (HAPD) y el cemento radicular (CR). El diente está conectado con el hueso mediante haces de fibras colágenas que pueden ser clasificadas en los siguientes grupos, conforme a su disposición: 1. Fibras crestoalveolares (FCA) 2. Fibras horizontales (FH) 3. Fibras oblicuas (FO) 4. Fibras apicales (FA)

Fig. 1-59 El ligamento periodontal y el cemento radicular se desarrollan a partir del tejido conjuntivo laxo (el folículo dentario) que rodea al germen dentario. El dibujo ilustra los diversos estadios de organización del ligamento periodontal, que se forma simultáneamente con el desarrollo de la raíz y la erupción del diente. Fig. 1-59a El germen dentario se forma en una cripta de hueso. Durante el proceso de maduración de las fibras colágenas producidas por los fibroblastos en el tejido conjuntivo laxo que circunda el germen dentario, esas fibras quedan incluidas en el cemento recién formado de localización inmediatamente apical con respecto a la unión cementoadamantina (UCA). Estos haces de fibras, orientados hacia la porción coronal de la cripta ósea, más tarde formarán el grupo de fibras dentogingivales (FDG), el grupo de fibras dentoperiósticas (FDP) y el grupo de fibras transeptales, que pertenecen a las fibras gingivales orientadas (véase Fig. 1-46). Fig. 1-59b Las verdaderas fibras del ligamento periodontal, las fibras principales, se desarrollan en conjunción con la erupción del diente. En primer término, las fibras pueden ser identificadas ingresar en la porción más marginal del hueso alveolar. Fig. 1-59c Después pueden verse haces de fibras colágenas orientadas más apicalmente. Fig. 1-59d La orientación de los haces de fibras colágenas se altera continuamente durante la fase de erupción del diente. Primero, cuando la oclusión funciona de manera correcta, las fibras del ligamento periodontal se asocian en grupos de fibras colágenas dentoalveolares bien orientadas, como se aprecia en la figura 1-58. Estas estructuras de colágeno experimentan remodelación constante (es decir, resorción de las fibras viejas y formación de fibras nuevas). (FDG, fibras dentogingivales; FDP, fibras dentoperiósticas; FCA; fibras crestoalveolares; HAPD, hueso alveolar propiamente dicho; FO, fibras oblicuas; FA, fibras apicales).
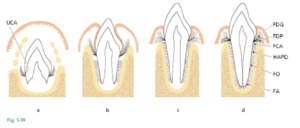
Fig. 1-60 Esquema que ilustra el desarrollo de las fibras principales del ligamento periodontal. El hueso alveolar propiamente dicho (HAPD) se ve a la izquierda, el ligamento periodontal (LP) en el centro y el cemento radicular (CR) a la derecha. Fig. 1-60a En primer término se detectan fibrillas pequeñas y delgadas con aspecto de cerdas de cepillo que emergen del cemento radicular y se proyectan en el espacio periodontal. En esta fase, la superficie del hueso está recubierta por osteoblastos. Desde la superficie del hueso puede verse sólo una pequeña cantidad de fibrillas colágenas delgadas y radiadas. Fig. 1-60b Más tarde aumenta la cantidad y el espesor de las fibras que ingresan en el hueso. Estas fibras se irradian hacia el tejido conjuntivo laxo de la zona central del ligamento periodontal (LP), que contiene fibrillas colágenas orientadas en forma aleatoria. Las fibras originadas en el cemento siguen siendo cortas, mientras que las que se anclan en el hueso se alargan gradualmente. Las porciones terminales de estas fibras tienen proyecciones digitiformes. Fig. 1-60c Las fibras que se originan en el cemento aumentan después su longitud y espesor y se fusionan dentro del espacio periodontal con las fibras provenientes del hueso alveolar. Después de la erupción, cuando el diente establece contacto oclusal y empieza a funcionar, las fibras principales se organizan en haces que discurren sin solución de continuidad desde el hueso hasta el cemento.
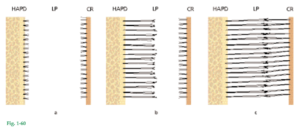
Fig. 1-61a Muestra cómo las fibras principales del ligamento periodontal (PDL) se dirigen sin solución de continuidad desde el cemento hasta el hueso alveolar propiamente dicho (ABP). Las fibras principales incluidas en el cemento (fibras de Sharpey) tienen diámetro menor que las incluidas en el hueso alveolar propiamente dicho, pero son más numerosas que estas últimas. Fig. 1-61b Versión con luz polarizada de la imagen de la figura 1-61a. En esta ilustración pueden verse las fibras de Sharpey (SF) que penetran no sólo en el cemento (C), sino en todo el espesor del hueso alveolar propiamente dicho (ABP). El ligamento periodontal contiene también unas pocas fibras elásticas asociadas con los vasos sanguíneos. Las fibras de oxitalano (véase Fig. 1-44) también están presentes en el ligamento periodontal. Éstas se orientan principalmente en sentido oclusoapical y dentro del ligamento están situadas más próximas al diente que al hueso alveolar; muy a menudo se insertan en el cemento. Su función no ha sido determinada. Las células del ligamento periodontal son: fibroblastos, osteoblastos, cementoblastos, osteoclastos y asimismo células epiteliales y fibras nerviosas. Los fibroblastos se alinean paralelos a las fibras principales, mientras que los cementoblastos recubren la superficie del cemento y los osteoblastos, la superficie del hueso.

Fig. 1-62a Imagen de grupos de células epiteliales (ER) en el ligamento periodontal (PDL). Estas células, denominadas restos epiteliales de Mallassez, representan remanentes de la vaina radicular epitelial de Hertwig. Las células epiteliales residuales están situadas en el ligamento periodontal a una distancia de 15 a 75 µm del cemento (C) de la superficie radicular. La figura 1-62b es una imagen con mayor aumento de un grupo de esas células epiteliales.

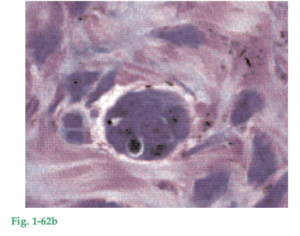
Fig. 1-63 Microfotografía electrónica en que se observa que los restos epiteliales están rodeados por una membrana basal (BM) y que la membrana plasmática de las células epiteliales muestra la presencia de desmosomas (D) y de hemidesmosomas (HD). Las células epiteliales contienen sólo algunas mitocondrias y su retículo endoplasmático está poco desarrollado. Esto significa que son células vivas pero en reposo, con metabolismo mínimo.

Fig. 1-64 Microfotografía de un ligamento periodontal separado de un diente extraído. La muestra, preparada en forma tangencial a la superficie radicular, muestra que los restos epiteliales de Mallassez, que en los cortes histológicos ordinarios aparecen como grupos aislados de células epiteliales, en realidad forman una red continua de células epiteliales que rodean la raíz. Hasta la fecha se desconocen sus funciones.

Cemento radicular
El cemento es un tejido mineralizado especializado que recubre las superficies radiculares y, en ocasiones, pequeñas porciones de la corona de los dientes. Posee muchas características en común con el tejido óseo. Sin embargo, el cemento no contiene vasos sanguíneos ni linfáticos, carece de inervación, no experimenta remodelación o resorción fisiológica y se caracteriza porque se deposita durante toda la vida. Al igual que otros tejidos mineralizados, contiene fibras colágenas incluidas en una matriz orgánica. El contenido mineral del cemento, principalmente hidroxiapatita, representa alrededor del 65% del peso, es decir que es un poco mayor que el del hueso (60%). El cemento cumple diferentes funciones. En él se insertan las fibras del ligamento periodontal y contribuye en el proceso de reparación cuando la superficie radicular ha sido dañada. Se describieron diferentes formas de cemento: 1. Cemento acelular de fibras extrínsecas (AEFC). Se encuentra en las porciones coronal y media de la raíz y contiene principalmente haces de fibras de Sharpey. Este tipo de cemento es una parte importante del aparato de inserción que conecta el diente con el hueso alveolar propiamente dicho. 2. Cemento celular mixto estratificado (CMSC). Se sitúa en el tercio apical de las raíces y en las furcaciones. Contiene fibras extrínsecas e intrínsecas y cementocitos. 3. Cemento celular con fibras intrínsecas (CIFC). Se encuentra, sobre todo, en lagunas de resorción y contiene fibras intrínsecas y cementocitos. Fig. 1-65a Porción de una raíz con el ligamento periodontal adyacente (PDL). Una capa delgada de cemento acelular de fibras extrínsecas (AEFC) densamente agrupadas recubre la dentina periférica. Pueden verse cementoblastos y fibroblastos junto al cemento. Fig. 1-65b Microfotografía electrónica de barrido del AEFC. Nótese que las fibras extrínsecas están fijadas en la dentina (izquierda) y se continúan con los haces de fibras colágenas (CB) del ligamento periodontal (PDL). El AEFC se forma al mismo tiempo que la dentina radicular. En un estadio determinado de la formación del diente se fragmenta la vaina epitelial de Hertwig, que recubre a la dentina recién formada. Las células del folículo dental penetran luego en la vaina epitelial de Hertwig y ocupan el área adyacente a la predentina. En esta posición, las células ectomesenquimáticas del folículo dental se diferencian en cementoblastos y empiezan a producir fibras colágenas en ángulo recto respecto de la superficie. El primer cemento se deposita en la muy mineralizada capa superficial de la dentina del manto, denominada “capa hialina”, la cual contiene proteínas de la matriz del esmalte y las primeras fibras colágenas del cemento. Más tarde, los cementoblastos se desplazan alejándose de la superficie; como resultado aumenta el espesor del cemento y se produce la incorporación de fibras principales.

Fig. 1-66 Estructura del cemento celular mixto estratificado (CMSC) que a diferencia del AEFC contiene células y fibras intrínsecas. El CMSC se deposita durante el período funcional del diente. Los diversos tipos de cemento son producidos por cementoblastos o por células del ligamento periodontal (PDL) que revisten la superficie del cemento. Algunas de estas células quedan incorporadas en el cementoide, que después se mineraliza y se torna en cemento. Las células que se incorporan en el cemento se denominan cementocitos (CC).

Fig. 1-67 Imagen que muestra cómo los cementocitos (célula azulada) residen en lagunas dentro del CMSC o del CIFC. Estas células se comunican entre sí por intermedio de una red de prolongaciones citoplasmáticas (flechas) que discurren por conductillos del cemento. Asimismo, mediante las prolongaciones citoplasmáticas de los cementocitos, estas células se comunican con cementoblastos de la superficie. La presencia de cementocitos permite el transporte de nutrientes a través del cemento y contribuye a conservar la vitalidad de este tejido mineralizado.
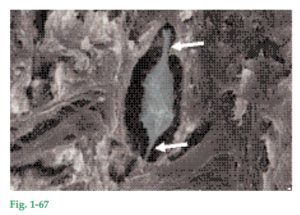
Fig. 1-68a Microfotografía de un corte a través del ligamento periodontal (PDL) en un área donde la raíz está recubierta de cemento acelular de fibras extrínsecas (AEFC). Las porciones de fibras principales del ligamento periodontal que están incluidas en el cemento radicular (flechas) y en el hueso alveolar propiamente dicho (ABP) se denominan fibras de Sharpey. Las flechas del lado derecho indican el límite entre ABP y hueso alveolar (AB). En el AEFC, las fibras de Sharpey tienen diámetro menor que en su contraparte en el hueso alveolar y están agrupadas más densamente. Durante la formación continua de AEFC, partes de las fibras del ligamento periodontal (fibras principales) adyacentes a la raíz quedan incluidas en el tejido mineralizado. Por consiguiente, las fibras de Sharpey del cemento son una continuación directa de las fibras principales del ligamento periodontal (PDL) y del tejido conjuntivo supralveolar. Fig. 1-68b Las fibras de Sharpey constituyen el sistema de fibras extrínsecas (E) del cemento y son producidas por fibroblastos en el ligamento periodontal. El sistema de fibras intrínsecas (I) es producido por los cementoblastos y se compone de fibras aproximadamente paralelas al eje mayor de la raíz.
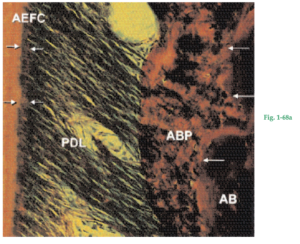

Fig. 1-69 Fibras extrínsecas que penetran en el cemento acelular de fibras extrínsecas (AEFC). Las bandas transversales características de las fibras colágenas están enmascaradas en el cemento debido a que durante el proceso de mineralización del tejido se han depositado cristales de apatita en los haces de fibras.

Fig. 1-70 A diferencia del hueso, el cemento (C) no tiene períodos alternantes de resorción y aposición, sino que aumenta de espesor en el curso de la vida por depósito de nuevas capas. Durante este proceso de aposición gradual se mineraliza la porción de las fibras principales inmediatamente adyacentes a la superficie radicular. La mineralización se produce por depósito de cristales de hidroxiapatita, primero dentro de las fibras colágenas, después sobre la superficie de la fibra y finalmente en la matriz interfibrilar. La microfotografía electrónica muestra un cementoblasto (CB) situado cerca de la superficie del cemento (C) y entre dos haces de fibras principales que se insertan en este tejido. Por lo general, el AEFC está más mineralizado que el CMSC y el CIFC. A veces sólo se mineraliza la periferia de las fibras de Sharpey del CMSC, por lo que queda un núcleo no mineralizado dentro de la fibra.
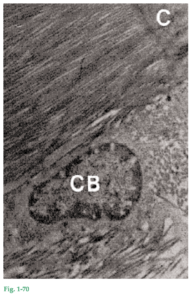
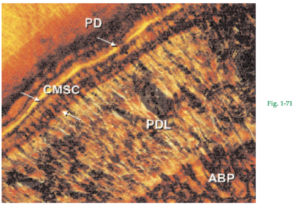
Fig. 1-71 Microfotografía del ligamento periodontal (PDL) ubicado entre el cemento (CMSC) y el hueso alveolar propiamente dicho (ABP). El CSMC posee alta densidad de fibras colágenas con orientación paralela a la superficie radicular (fibras intrínsecas) y de fibras de Sharpey (fibras extrínsecas), orientadas en forma aproximadamente perpendicular a la unión cementodentinaria (predentina, PD). El cemento se hace mucho más grueso en la porción apical de la raíz que en la porción cervical, donde el espesor es de sólo 20 a 50 µm. En la porción apical de la raíz, por lo común el cemento tiene entre 150 y 250 µm de espesor. A menudo, el cemento contiene líneas incrementales, indicadoras de períodos de formación alternados. El CMSC se forma después de terminada la erupción del diente y como respuesta a las demandas funcionales.
Hueso alveolar
La apófisis alveolar se define como la parte de los maxilares superior e inferior que forma y sostiene los alvéolos de los dientes. La apófisis alveolar está compuesta por hueso que se forma tanto por células del folículo o saco dentario (hueso alveolar propiamente dicho) como por células que son independientes del desarrollo dentario. Junto con el cemento radicular y el ligamento periodontal, el hueso alveolar constituye el aparato de inserción del diente, cuya función principal consiste en distribuir y absorber las fuerzas generadas por la masticación y otros contactos dentarios. Fig. 1-72 Corte transversal que pasa por la apófisis alveolar (parte alveolar) del maxilar superior a nivel central de las raíces dentales. Nótese que el hueso que recubre las superficies radiculares es mucho más grueso en la cara palatina que en la cara vestibular del maxilar. Las paredes de los alvéolos están revestidas por hueso cortical (flechas) y el área entre los alvéolos y las paredes de hueso compacto del maxilar está ocupada por hueso esponjoso. Éste ocupa la mayor parte de los tabiques interdentales, pero sólo una porción relativamente pequeña de las tablas óseas vestibular y palatina. El hueso esponjoso contiene trabéculas óseas cuya arquitectura y dimensiones están determinadas en parte genéticamente y en parte como resultado de las fuerzas a las cuales están expuestos los dientes durante la masticación. Nótese cómo el hueso de las caras vestibular y palatina de la apófisis alveolar varía de espesor entre una y otra región. La tabla ósea es gruesa en la cara palatina y en la cara vestibular de los molares, pero en la cara vestibular de la región anterior es delgada.
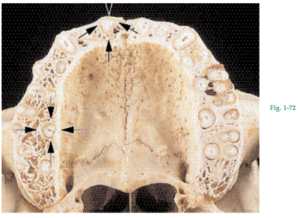
Fig. 1-73 Cortes transversales que pasan a través de la apófisis alveolar del maxilar inferior, por niveles correspondientes a los tercios coronal (Fig. 1-73a) y apical (Fig. 1-73b) de las raíces. El hueso que reviste la pared de los alvéolos (hueso alveolar propiamente dicho) a menudo se continúa con el hueso compacto o cortical en las caras lingual (L) y vestibular (B) de la apófisis alveolar (flechas). Nótese que el hueso de las caras vestibular y lingual de la apófisis alveolar varía de espesor de una a otra región. En las regiones de incisivos y molares, la tabla ósea ante la cara vestibular de los dientes es mucho más delgada que en la cara lingual. En la región de los molares, el hueso es más grueso en la superficie vestibular que en la lingual.
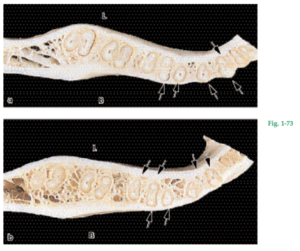
Fig. 1-74 A veces falta recubrimiento óseo en la porción coronal de las raíces en la cara vestibular de los maxilares, por lo que se conforma la denominada dehiscencia (D). Cuando existe una parte de hueso en la porción más coronaria de tal área, el defecto se describe como fenestración (F). Estos defectos ocurren a menudo cuando un diente es desplazado fuera del arco y son más frecuentes en los dientes anteriores que en los posteriores. En estos defectos, la raíz está cubierta sólo por el ligamento periodontal y el revestimiento gingival.
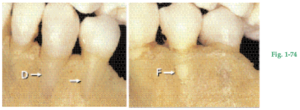
Fig. 1-75 Cortes verticales a través de diversas regiones de la dentadura mandibular. La pared ósea en las caras vestibular (V) y lingual (L) varía considerablemente su espesor, por ejemplo, desde la región premolar hasta la región molar. Nótese cómo la presencia de la línea oblicua da por resultado una prominencia ósea en forma de repisa (flechas) en la cara vestibular a nivel del segundo y del tercer molar.

Fig. 1-76 Corte a través de ligamento periodontal (PL), diente (T) y hueso alveolar (AB). Los vasos sanguíneos del ligamento periodontal y el hueso alveolar se ven en negro porque se prefundió tinta en el sistema vascular. El hueso compacto (hueso alveolar propiamente dicho) que reviste el alvéolo dental y que en una radiografía (Fig. 1-57) aparece como “lámina dura” (LD), está perforado por numerosos conductos de Volkmann (flechas) por donde pasan vasos sanguíneos, linfáticos y fibras nerviosas, que van desde el hueso alveolar hasta el ligamento periodontal (PL). Esta capa de hueso en la cual se insertan las fibras principales (fibras de Sharpey) es el hueso alveolar propiamente dicho o “hueso fasciculado”. Desde los puntos de vista estructural y funcional, este “hueso fasciculado” tiene varias características en común con la capa de cemento situada sobre la superficie radicular.
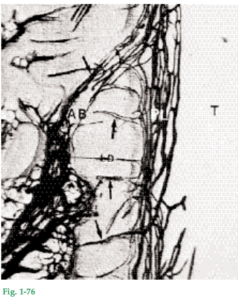
Fig. 1-77 La apófisis alveolar se empieza a formar tempranamente durante la vida fetal, con depósito de minerales en pequeños focos de la matriz mesenquimática que rodea los brotes dentarios. Estas pequeñas áreas mineralizadas aumentan de tamaño, se fusionan y son resorbidas y remodeladas hasta que se forma una masa ósea continua en torno de los dientes totalmente erupcionados. El contenido mineral del hueso, que se compone principalmente de hidroxiapatita, constituye aproximadamente el 60% del peso. La microfotografía ilustra el tejido óseo dentro del área de furcación de un molar mandibular. El tejido óseo puede ser dividido en dos compartimientos: hueso mineralizado (MB) y médula ósea (BM). El hueso mineralizado está formado por laminillas –hueso laminar– mientras que la médula ósea contiene adipocitos (ad), estructuras vasculares (v) y células mesenquimáticas indiferenciadas (véase el recuadro incluido en la figura).

Fig. 1-78 El hueso laminar mineralizado incluye dos tipos de tejido: el hueso de la apófisis alveolar (AB) y el hueso alveolar propiamente dicho o fasciculado (ABP) que reviste al alvéolo. El ABP tiene espesor variado y se señala con flechas blancas. El hueso alveolar (AB) es un tejido de origen mesenquimático y no se lo considera parte del aparato de inserción genuino. Por otro lado, el hueso alveolar propiamente dicho (ABP) junto con el ligamento periodontal (PDL) y el cemento (C) son los responsables de la inserción entre diente y esqueleto. Las partes AB y ABP pueden estar sometidas a cambios adaptativos como resultado de alteraciones en la demanda funcional.
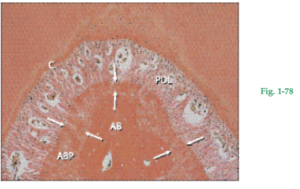
Fig. 1-79 Imagen de una porción de hueso laminar. En este sitio, el hueso laminar contiene osteones (círculos blancos), cada uno de los cuales contiene un vaso sanguíneo situado en un conducto de Havers (CH). El vaso sanguíneo rodeado de laminillas concéntricas mineralizadas conforma un osteón. El espacio entre los distintos osteones está ocupado por las denominadas laminillas intersticiales. Los osteones del hueso laminar no sólo son unidades estructurales, sino también unidades metabólicas. De este modo, la nutrición del hueso está asegurada por los vasos sanguíneos de los conductos de Havers y los vasos conectores de los conductos de Volkmann.

Fig. 1-80 El corte histológico (Fig. 1-80a) muestra el límite entre el hueso alveolar propiamente dicho (HAPD) y el hueso alveolar con un osteón. Nótese la presencia del conducto de Havers (CH) en el centro del osteón. El hueso alveolar propiamente dicho incluye laminillas circunferenciales y contiene fibras de Sharpey que se extienden dentro del ligamento periodontal. El dibujo (Fig. 1-80b) ilustra tres osteones activos (pardo) con un vaso sanguíneo (rojo) dentro del conducto haversiano. Entre los osteones (O) hay laminillas intersticiales (verde), que representan un osteón viejo y parcialmente remodelado. El hueso alveolar propiamente dicho (HAPD) está representado por líneas oscuras, en las cuales se insertan fibras de Sharpey (FS).

Fig. 1-81 Osteón con osteocitos (OC) localizados en las lagunas osteocíticas del hueso laminar. Los osteocitos se conectan por vía de conductillos (CON) que contienen proyecciones citoplasmáticas de estas células. En el centro del osteón se ve un conducto de Havers (CH).
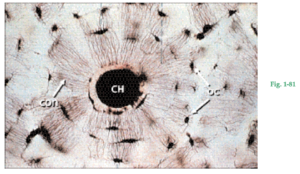
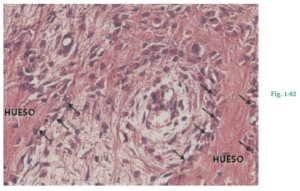
Fig. 1-82 Área de hueso alveolar en la que existe formación de hueso. Los osteoblastos (flechas), células formadoras de hueso, están produciendo matriz ósea (osteoide) consistente en fibras colágenas, glucoproteínas y proteoglucanos. La matriz ósea u osteoide se mineraliza por los depósitos de minerales como calcio y fosfato, que después se transforman en hidroxiapatita.
LorFig. 1-83 Dibujo que ilustra cómo los osteocitos (OC) presentes en el hueso mineralizado se comunican a través de conductillos (CON) con los osteoblastos (OB) de la superficie ósea.
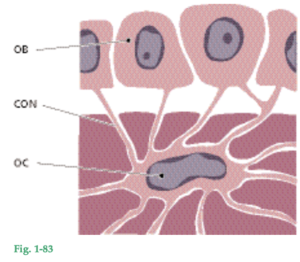
Fig. 1-84 Todos los sitios con formación activa de hueso alojan osteoblastos. La superficie externa del hueso está recubierta por una capa de osteoblastos que a su vez se organizan formando un periostio (P), que contiene grupos densos de fibras colágenas. En la “superficie interna” del hueso, es decir, en el espacio ocupado por la médula ósea, existe un endostio (E), cuyas características son similares a las del periostio.

Fig. 1-85 Microfotografía de un osteocito ubicado en una laguna osteocítica. Pueden verse las prolongaciones citoplasmáticas radiadas en diferentes direcciones.
Fig. 1-86 Ilustración de osteocitos (OC) y la forma en que sus largas y delicadas prolongaciones citoplasmáticas se comunican a través de conductillos (CON). El sistema resultante de conductillos y lagunas es fundamental para el metabolismo celular, pues permite la difusión de nutrientes y productos de desecho. Es muy grande la superficie de contacto entre los osteocitos con sus prolongaciones citoplasmáticas de un lado y la matriz mineralizada del otro. Se ha calculado que en un cubo de hueso de 10 × 10 × 10 cm, la interfaz de células y matriz llega aproximadamente a 250 m2 . Esta enorme superficie de intercambio sirve, por ejemplo, como regulador de los niveles de calcio y de fosfato séricos a través de mecanismos hormonales de control.
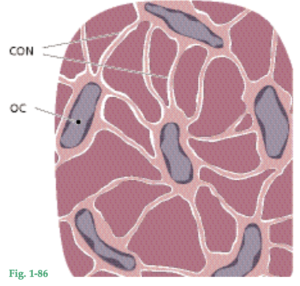
Fig. 1-87 El hueso alveolar se renueva constantemente en respuesta a las demandas funcionales. Los dientes erupcionan y migran en dirección mesial durante toda la vida, para compensar el desgaste. Esos movimientos dentarios implican una remodelación del hueso alveolar. Durante el proceso de remodelación, las trabéculas óseas son resorbidas y reformadas continuamente y la masa de hueso cortical es disuelta y reemplazada por hueso nuevo. Durante la degradación del hueso cortical se forman conductos de resorción por la proliferación de vasos sanguíneos. Esos conductos, que en el centro contienen un vaso sanguíneo, son rellenados más tarde con hueso nuevo por la formación de laminillas dispuestas en capas concéntricas en torno del vaso sanguíneo. En la microfotografía de un corte horizontal que pasa por hueso alveolar (HA), ligamento periodontal (LP) y diente (D) se ve un nuevo sistema de Havers (O). (CH; conducto de Havers).

Fig. 1-88 La resorción ósea siempre está asociada con los osteoclastos (Ocl). Éstos son células gigantes, especializadas en la degradación de matriz ósea mineralizada (hueso, dentina, cemento) y probablemente se desarrollan a partir de los monocitos de la sangre. La resorción se produce por liberación de sustancias ácidas (ácido láctico, etc.), que forman un medioambiente ácido en el cual se disuelven las sales minerales del tejido óseo. Las sustancias orgánicas remanentes son eliminadas por la acción de enzimas y la fagocitosis osteoclástica. Sobre la superficie del hueso se adhieren osteoclastos activos en la resorción, que originan depresiones lacunares denominadas lagunas de Howship (línea de puntos). Los osteoclastos son móviles y capaces de migrar sobre la superficie del hueso. La microfotografía muestra la actividad osteoclástica en la superficie del hueso alveolar (HA).
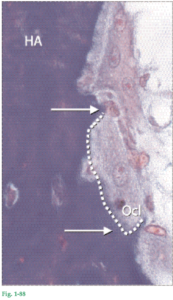
Fig. 1-89 Ilustración de la llamada unidad ósea multicelular, que se halla en el tejido óseo en proceso de remodelación. La línea de inversión, señalada por flechas rojas, muestra hasta qué nivel se produjo resorción ósea. Desde la línea de inversión se ha empezado a formar hueso nuevo, con características osteoides. Nótese la presencia de osteoblastos (ob) y de estructuras vasculares (V). Los osteoclastos resorben sustancias orgánicas e inorgánicas.
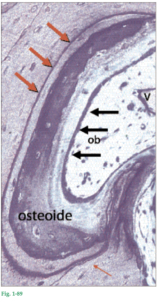
Fig. 1-90 La cortical y el hueso esponjoso alveolar están sometidos a remodelación constante (es decir, resorción seguida de formación) en respuesta al desplazamiento del diente y a cambios en las fuerzas funcionales que operan sobre los dientes. La remodelación del hueso trabecular comienza con la resorción de la superficie ósea por acción de los osteoclastos (OCL), como se ve en la figura 1-90a. Después de un corto período, los osteoblastos (OB) empiezan a depositar hueso nuevo (Fig. 1-90b) y por último se forma una nueva unidad ósea multicelular, delimitada nítidamente por una línea de inversión (flechas) como se observa en la figura 1-90c.

Fig. 1-91 Las fibras colágenas del ligamento periodontal (PL) se insertan en el hueso mineralizado que reviste la pared del alvéolo dental. Este hueso, que como ya se dijo, se denomina hueso alveolar propiamente dicho o hueso fascicular (BB), tiene una alta tasa de recambio. Las porciones de fibras colágenas que están insertadas en el hueso alveolar propiamente dicho se llaman fibras de Sharpey (SF). Estas fibras están mineralizadas en su periferia, pero a menudo tienen un núcleo central sin mineralizar. Los haces de fibras colágenas que se insertan en el hueso alveolar propiamente dicho tienen por lo general mayor diámetro y son menos numerosos que los que se insertan en el cemento, en el lado opuesto del ligamento periodontal. Cada haz de fibras puede ser rastreado en todo su recorrido desde el hueso alveolar hasta el cemento. Sin embargo, a pesar de hallarse en el mismo haz de fibras, por lo general el colágeno adyacente al hueso es siempre menos maduro que el adyacente al cemento. En el lado dentario, el colágeno tiene una tasa de recambio baja. Por eso, mientras que el colágeno adyacente al hueso se renueva en forma bastante rápida, el adyacente a la superficie radicular se renueva lentamente o no se renueva. Nótese la presencia de osteoblastos (OB) y de osteocitos (OC).
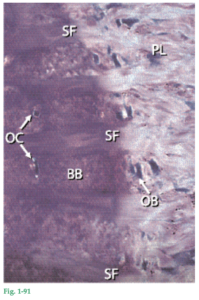
Irrigación sanguínea del periodonto Fig. 1-92 Este esquema ilustra la irrigación sanguínea de los dientes y de los tejidos periodontales. La arteria dental (a.d.), rama de la arteria alveolar superior o inferior (a.a.i.) emite la arteria intraseptal (a.i.) antes de ingresar en el alvéolo dental. Las ramas terminales de la arteria intraseptal (ramas perforantes, r.p.) penetran en el hueso alveolar propiamente dicho atravesando conductos, a todos los niveles del alvéolo (véase Fig. 1-76). Estas ramas se anastomosan en el espacio periodontal con vasos sanguíneos originados en la porción apical del ligamento periodontal y con otras ramas terminales de la arteria intraseptal. Antes de que la arteria dental ingrese en el conducto radicular, emite una o dos ramas que irrigan la porción apical del ligamento periodontal.
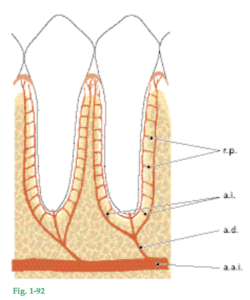
Fig. 1-93 La encía recibe su irrigación sanguínea principalmente a través de vasos sanguíneos supraperiósticos que son ramas terminales de la arteria sublingual (a.s.), la arteria mentoniana (a.m.), la arteria bucal (a.b.), la arteria facial (a.f.), la arteria palatina mayor (a.p.), la arteria infraorbitaria (a.i.) y la arteria dental posterosuperior (a.d.p.s.).

Fig. 1-94 Recorrido de la arteria palatina mayor (a.p.) en una pieza anatómica de un mono perfundido con plástico en el momento de sacrificarlo. Después se procedió a disolver los tejidos blandos. La arteria palatina mayor, que es rama terminal de la arteria palatina ascendente (rama de la “arteria maxilar interna” de la maxilar) entra en el paladar a través del conducto palatino mayor (flecha). A medida que esta arteria se dirige hacia adelante emite ramas que irrigan la encía y la mucosa masticatoria del paladar.
Fig. 1-95 Es común considerar que son diversas arterias las que irrigan ciertas regiones bien definidas de la dentadura. Sin embargo, en realidad se trata de numerosas anastomosis existentes entre las distintas arterias. Por consiguiente, debe considerarse que la irrigación de los tejidos duros y blandos de los maxilares superior e inferior es provista por todo el sistema de vasos sanguíneos y no por grupos individuales de vasos; por ejemplo, en esta figura hay una anastomosis (flecha) entre la arteria facial (a.f.) y los vasos sanguíneos de la mandíbula.
Fig. 1-96 Segmento vestibular de los maxilares superior e inferior de un mono que fue perfundido con plástico en el momento de sacrificarlo. Nótese que la encía vestibular está irrigada principalmente por vasos sanguíneos supraperiósticos (flechas).

LorFig. 1-97 Puede verse que los vasos sanguíneos (flechas) que se originan en vasos del ligamento periodontal pasan a través de la cresta del hueso alveolar y contribuyen a la irrigación sanguínea de la encía libre.

Fig. 1-98 Pieza anatómica de un mono que fue perfundido con tinta en el momento de ser sacrificado. Después, esta pieza fue tratada para tornar transparentes los tejidos (aclaramiento de la muestra).
Hacia la derecha pueden verse los vasos sanguíneos supraperiósticos (sv). En su recorrido hacia la encía libre emiten numerosas ramas hacia el plexo subepitelial (sp), situado inmediatamente por debajo del epitelio bucal de la encía libre y adherida. A su vez, el plexo subepitelial emite delgadas asas capilares para cada una de las papilas de tejido conjuntivo que se proyectan dentro del epitelio bucal (OE). La cantidad de esas asas capilares se mantiene constante por largo tiempo y no se altera por la aplicación de epinefrina (adrenalina) o histamina en el borde gingival. Esto implica que, aun en circunstancias normales, los vasos sanguíneos de las porciones laterales de la encía se utilizan por completo y que el flujo sanguíneo de la encía libre está regulado en su totalidad por las variaciones de la velocidad circulatoria. En la encía libre, los vasos sanguíneos supraperiósticos (sv) se anastomosan con vasos del ligamento periodontal y del hueso. Por debajo del epitelio de unión (JE) que se ve a la izquierda, hay un plexo de vasos sanguíneos denominado plexo dentogingival (dp). Los vasos sanguíneos de este plexo tienen alrededor de 40 µm de espesor, lo que significa que son principalmente vénulas. En la encía sana no hay asas capilares en el plexo dentogingival.
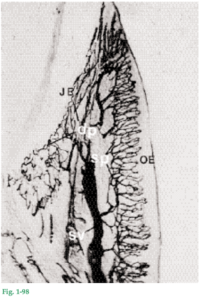
Fig. 1-99 Este preparado ilustra cómo el plexo subepitelial (sp), situado por debajo del epitelio bucal de la encía libre y la encía adherida, emite delgadas asas capilares para cada papila de tejido conjuntivo. Estas asas capilares tienen aproximadamente 7 µm de diámetro, lo cual significa que sus dimensiones son las propias de los capilares.
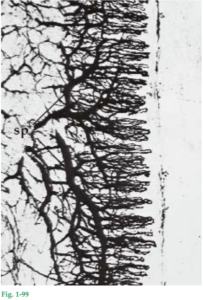
Fig. 1-100 Preparado de un corte paralelo a la subsuperficie del epitelio de unión en el que se observa el plexo dentogingival. Como puede verse, éste se compone de una malla de vasos sanguíneos de fino calibre. En la porción superior de la figura se ven asas capilares correspondientes al plexo subepitelial, ubicado debajo del epitelio del surco.

Fig. 1-101 Esquema de la irrigación sanguínea de la encía libre. Como ya se dijo, la irrigación sanguínea principal de la encía libre deriva de los vasos sanguíneos supraperiósticos (v.s.p.o.) que en la encía se anastomosan con vasos del hueso alveolar (H.A.) y del ligamento periodontal (l.p.). A la derecha del dibujo está el epitelio bucal (E.B.) con su plexo vascular subepitelial (p.v.s.e.) subyacente. A la izquierda, por debajo del epitelio de unión (E.U.), se ve el plexo dentogingival (p.d.) que en condiciones normales comprende una malla fina sin asas capilares.
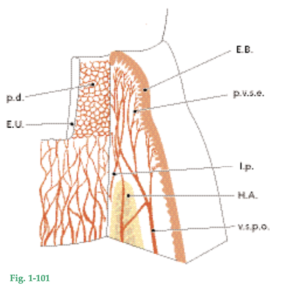
Fig. 1-102 Corte de un diente (T) con su periodonto. Los vasos sanguíneos (ramas perforantes; flechas) originados en la arteria intraseptal del hueso alveolar, discurren a través de conductos (conductos de Volkmann) en la pared alveolar (VC) hasta el ligamento periodontal (PL), donde se anastomosan.

Fig. 1-103 Vasos sanguíneos del ligamento periodontal en un corte paralelo a la superficie radicular. Después de ingresar en el ligamento periodontal, los vasos sanguíneos (ramas perforantes; flechas), se anastomosan y forman una red poliédrica que rodea la raíz de manera similar a una “media de red”. La mayor parte de los vasos sanguíneos del ligamento periodontal se hallan cerca del hueso alveolar. En la porción coronal del ligamento periodontal los vasos sanguíneos discurren en dirección coronal pasando la cresta ósea alveolar hasta la encía libre (véase Fig. 1-97).
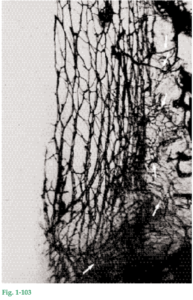
Fig. 1-104 Esquema de la irrigación sanguínea del periodonto. En el ligamento periodontal, los vasos sanguíneos forman una red poliédrica que rodea la raíz. Nótese que la encía libre recibe su irrigación sanguínea de: 1) vasos sanguíneos supraperiósticos, 2) vasos sanguíneos del ligamento periodontal y 3) vasos sanguíneos del hueso alveolar.

Fig. 1-105 Representación esquemática de la denominada circulación extravascular, a través de la cual se transportan nutrientes y otras sustancias a cada célula y se eliminan desechos metabólicos de los tejidos. En el extremo arterial (A) del capilar, a la izquierda del dibujo, se mantiene una presión hidrostática de aproximadamente 35 mm Hg, como resultado de la función de bomba del corazón. Como en el tejido la presión hidrostática es mayor que la presión osmótica (PO; de aproximadamente 30 mm Hg), habrá de producirse un transporte de sustancias desde los vasos sanguíneos hacia el espacio extravascular (EEV). En el extremo venoso (V) del sistema capilar, a la derecha del dibujo, la presión hidrostática se redujo hasta alrededor de 25 mm Hg (5 mm Hg menos que la presión osmótica en el tejido). Esto permite el transporte de sustancias desde el espacio extravascular hacia los vasos sanguíneos. Por consiguiente, la diferencia entre la presión hidrostática y la presión osmótica da por resultado el transporte de sustancias desde los vasos sanguíneos hacia el espacio extravascular en la parte arterial del sistema capilar, mientras que en la parte venosa ocurre el transporte de sustancias desde el espacio extravascular hacia los vasos sanguíneos. De esta forma se establece una circulación extravascular (flechas pequeñas).
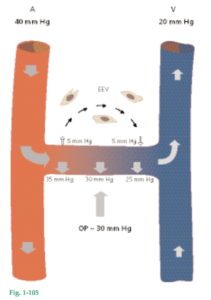
Sistema linfático del periodonto Fig. 1-106 Los vasos linfáticos más pequeños, que son los capilares linfáticos, forman una amplia red en el tejido conjuntivo. La pared de un capilar linfático consta de una capa única de células endoteliales. Por esta razón, tales capilares son difíciles de identificar en un corte histológico ordinario. La linfa es absorbida desde el líquido tisular a través de la delgada pared de los capilares linfáticos. Desde los capilares, la linfa pasa a vasos linfáticos de mayor calibre, que a menudo están cerca de los vasos sanguíneos correspondientes. Antes de que la linfa ingrese en la corriente sanguínea, pasa por uno o más ganglios linfáticos en los que es filtrada y recibe linfocitos. Los vasos linfáticos son como venas provistas de válvulas. La linfa proveniente de los tejidos periodontales drena en los ganglios linfáticos de la cabeza y el cuello. La encía vestibular y lingual de la región de los incisivos inferiores drena hacia los ganglios linfáticos submentonianos (g.s.me.). La encía palatina del maxilar superior drena hacia los ganglios linfáticos cervicales profundos (g.c.p.). La encía vestibular del maxilar superior y la encía vestibular y lingual de la región de premolares y molares de la mandíbula drenan en los ganglios linfáticos submandibulares (g.s.ma.). Todos los dientes y sus tejidos periodontales adyacentes, excepto los terceros molares y los incisivos inferiores, drenan en los ganglios linfáticos submandibulares. Los terceros molares drenan hacia el ganglio

Nervios del periodonto
Al igual que otros tejidos del cuerpo, el periodonto contiene receptores que registran dolor, tacto y presión (nociceptores y mecanorreceptores). Además de los diferentes tipos de receptores sensitivos, también hay componentes nerviosos que inervan los vasos sanguíneos del periodonto. Los nervios para el dolor, el tacto y la presión tienen su centro trófico en el ganglio semilunar y llegan al periodonto a través del nervio trigémino y sus ramos terminales. La presencia de receptores en el ligamento periodontal permite reconocer fuerzas pequeñas que actúan sobre los dientes. Por ejemplo, es fácil identificar la presencia de una lámina metálica muy delgada (10 a 30 µm) aplicada entre los dientes durante la oclusión. Es bien conocido que si durante el movimiento que lleva a contactar los dientes de la mandíbula con las superficies oclusales del maxilar superior, se detecta un objeto duro, el movimiento es detenido en forma refleja y transformado en otro de apertura. Por ende, los receptores situados en el ligamento periodontal, junto con los propioceptores en músculos y tendones desempeñan un papel fundamental en la regulación de los movimientos masticatorios y de las fuerzas que requiere. Fig. 1-107 Fotografías de las diversas regiones de la encía que son inervadas por ramos terminales del nervio trigémino. La encía de la cara vestibular de los incisivos, caninos y premolares superiores está inervada por los ramos labiales superiores del nervio infraorbitario (Fig. 1-107a). La encía vestibular de las regiones molares superiores está inervada por ramos del nervio dentario superior posterior (r. n. dent. sup. post.; Fig. 1-107a). La encía palatina es inervada por el nervio palatino mayor (Fig. 1-107b), excepto en el área de los incisivos, donde es inervada por el nervio esfenopalatino largo. En el maxilar inferior, la encía lingual es inervada por el nervio sublingual (Fig. 1-107c), ramo terminal del nervio lingual. La encía de la cara vestibular de incisivos y caninos inferiores está inervada por el nervio mentoniano y la encía de la cara vestibular de los molares, por el nervio bucal (Fig. 1-107a). Las áreas de inervación de estos dos nervios frecuentemente se superponen en la región premolar. Los dientes mandibulares y sus ligamentos periodontales están inervados por el nervio alveolar inferior, mientras que los dientes del maxilar superior están inervados por el plexo alveolar superior.

Fig. 1-108 En el periodonto, los pequeños nervios siguen casi el mismo recorrido que los vasos sanguíneos. Los nervios de la encía discurren por tejido superficial respecto del periostio y emiten varios ramos para el epitelio bucal en su trayecto hacia la encía libre. Los nervios ingresan en el ligamento periodontal a través de perforaciones (conductos de Volkmann) de la pared alveolar (véase Fig. 1-102). En el ligamento periodontal, los nervios se unen en fascículos mayores que adoptan un recorrido paralelo al eje mayor del diente. La microfotografía ilustra pequeños nervios (flechas) que emergieron de fascículos mayores de nervios ascendentes, a efectos de inervar determinadas partes del tejido del ligamento periodontal. En éste han sido identificados diferentes tipos de terminaciones nerviosas, como terminaciones nerviosas libres y corpúsculos de Ruffini.
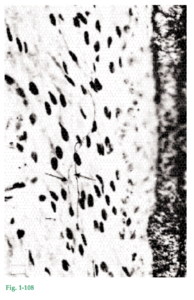
BIBLIOGAFIA
Ainamo, J. & Talari, A. (1976). The increase with age of the width of attached gingiva. Journal of Periodontal Research 11, 182–188. Anderson, D.T., Hannam, A.G. & Matthews, G. (1970). Sensory mechanisms in mammalian teeth and their supporting structures. Physiological Review 50, 171–195. Bartold, P.M. (1995). Turnover in periodontal connective tissue: dynamic homeostasis of cells, collagen and ground substances. Oral Diseases 1, 238–253. Beertsen, W., McCulloch, C.A.G. & Sodek, J. (1997). The periodontal ligament: a unique, multifunctional connective tissue. Periodontology 2000 13, 20–40. Bosshardt, D.D. & Schroeder, H.E. (1991). Establishment of acellular extrinsic fiber cementum on human teeth. A lightand electron-microscopic study. Cell Tissue Research 263, 325–336. Bosshardt, D.D. & Selvig, K.A. (1997). Dental cementum: the dynamic tissue covering of the root. Periodontology 2000 13, 41–75. Carranza, E.A., Itoiz, M.E., Cabrini, R.L. & Dotto, C.A. (1966). A study of periodontal vascularization in different laboratory animals. Journal of Periodontal Research 1, 120–128. Egelberg, J. (1966). The blood vessels of the dentogingival junction. Journal of Periodontal Research 1, 163–179. Fullmer, H.M., Sheetz, J.H. & Narkates, A.J. (1974). Oxytalan connective tissue fibers. A review. Journal of Oral Pathology 3, 291–316. Hammarström, L. (1997). Enamel matrix, cementum development and regeneration. Journal of Clinical Periodontology 24, 658–677. Karring, T. (1973). Mitotic activity in the oral epithelium. Journal of Periodontal Research, Suppl. 13, 1–47. Karring, T. & Löe, H. (1970). The three-dimensional concept of the epithelium-connective tissue boundary of gingiva. Acta Odontologica Scandinavia 28, 917–933. Karring, T., Lang, N.R. & Löe, H. (1974). The role of gingival connective tissue in determining epithelial differentiation. Journal of Periodontal Research 10, 1–11. Karring, T., Ostergaard, E. & Löe, H. (1971). Conservation of tissue specificity after heterotopic transplantation of gingiva and alveolar mucosa. Journal of Periodontal Research 6, 282–293. Kvam, E. (1973). Topography of principal fibers. Scandinavian Journal of Dental Research 81, 553–557. Lambrichts, I., Creemers, J. & van Steenberghe, D. (1992). Morphology of neural endings in the human periodontal ligament: an electron microscopic study. Journal of Periodontal Research 27, 191–196. Listgarten, M.A. (1966). Electron microscopic study of the gingivo-dental junction of man. American Journal of Anatomy 119, 147–178. Listgarten, M.A. (1972). Normal development, structure, physiology and repair of gingival epithelium. Oral Science Review 1, 3–67. Lozdan, J. & Squier, C.A. (1969). The histology of the mucogingival junction. Journal of Periodontal Research 4, 83–93. Melcher, A.H. (1976). Biological processes in resorption, deposition and regeneration of bone. In: Stahl, S.S., ed. Periodontal Surgery, Biologic Basis and Technique. Springfield: C.C. Thomas, pp. 99–120. Page, R.C., Ammons, W.F., Schectman, L.R. & Dillingham, L.A. (1974). Collagen fiber bundles of the normal marginal gingiva in the marmoset. Archives of Oral Biology 19, 1039–1043. Palmer, R.M. & Lubbock, M.J. (1995). The soft connective tissue of the gingiva and periodontal ligament: are they unique? Oral Diseases 1, 230–237. Saffar, J.L., Lasfargues, J.J. & Cherruah, M. (1997). Alveolar bone and the alveolar process: the socket that is never stable. Periodontology 2000 13, 76–90. Schenk, R.K. (1994). Bone regeneration: Biologic basis. In: Buser, D., Dahlin, C. & Schenk, R. K., eds. Guided Bone Regeneration in Implant Dentistry. Berlin: Quintessence Publishing Co. Schroeder, H.E. (1986). The periodontium. In: Schroeder, H. E., ed. Handbook of Microscopic Anatomy. Berlin: Springer, pp. 47–64. Schroeder, H.E. & Listgarten, M.A. (1971). Fine Structure of the Developing Epithelial Attachment of Human Teeth, 2nd edn. Basel: Karger, p. 146. Schroeder, H.E. & Listgarten, M.A. (1997). The gingival tissues: the architecture of periodontal protection. Periodontology 2000 13, 91–120. Schroeder, H.E. & Münzel-Pedrazzoli, S. (1973). Correlated morphometric and biochemical analysis of gingival tissue. Morphometric model, tissue sampling and test of stereologic procedure. Journal of Microscopy 99, 301–329. Schroeder, H.E. & Theilade, J. (1966). Electron microscopy of normal human gingival epithelium. Journal of Periodontal Research 1, 95–119. Selvig, K.A. (1965). The fine structure of human cementum. Acta Odontologica Scandinavica 23, 423–441. Valderhaug, J.R. & Nylen, M.U. (1966). Function of epithelial rests as suggested by their ultrastructure. Journal of Periodontal Research 1, 67–78.